Het ontstaan van de kwantummechanica
 Vanaf circa 1900 ontdekten natuurkundigen steeds meer verschijnselen die niet meer met de klassieke wetten verklaard konden worden. Er werden nieuwe hypotheses opgesteld en langzamerhand begon men daar patronen in te herkennen. Het leidde tot de kwantummechanica in 1925, een theorie waarmee het gedrag van materie op atomair niveau bijzonder goed te beschrijven bleek. De klassieke wetten uit de macroscopische wereld bleken limietgevallen te zijn van de kwantummechanische wetten.
Vanaf circa 1900 ontdekten natuurkundigen steeds meer verschijnselen die niet meer met de klassieke wetten verklaard konden worden. Er werden nieuwe hypotheses opgesteld en langzamerhand begon men daar patronen in te herkennen. Het leidde tot de kwantummechanica in 1925, een theorie waarmee het gedrag van materie op atomair niveau bijzonder goed te beschrijven bleek. De klassieke wetten uit de macroscopische wereld bleken limietgevallen te zijn van de kwantummechanische wetten.Verschuiving in het denken
Aan het einde van de negentiende eeuw dacht men dat de fysische verschijnselen in grote trekken bekend en verklaard waren. Deeltjesbewegingen konden succesvol beschreven worden wanneer men uitging van de wetten van Newton, golfverschijnselen uitgaande van de wetten van Maxwell. -fig 1- een gas-molecuul met impuls mv in een afgesloten omgeving / Bron: Chemistry libre texts
-fig 1- een gas-molecuul met impuls mv in een afgesloten omgeving / Bron: Chemistry libre texts- de kinetische gastheorie
- de thermodynamica (zie figuur 1, basismodel kinetische gastheorie).
Het leek alsof de natuurkunde voltooid was, en wat resteerde was slechts het invullen van de details.
De fysici van die tijd dachten deterministisch: is de begintoestand van een systeem bekend, dan is, uitgaande van de bekende natuurwetten, de verandering van het systeem in de tijd helemaal te voorspellen. Het enige probleem betrof de technische uitvoering: hoe alle variabelen op bepaalde tijd te meten, hoe het noodzakelijke rekenwerk in acceptabele tijd uit te voeren.
Van de atomaire wereld was nog weinig bekend. Omdat de kinetische gastheorie zo'n succes was, dacht men dat de verschijnselen op atomaire schaal ook aan dezelfde fysische wetten zouden gehoorzamen. Vanaf circa 1900 werden echter steeds meer atomaire verschijnselen ontdekt, die met de klassieke wetten niet verklaard konden worden.
In deze periode begon men ad-hoc hypotheses in te voeren, die in strijd waren met deze klassieke wetten.
Formulering van de kwantummechanica
Eerst was er ongeloof, maar langzamerhand – met het groeien van het aantal hypotheses – herkende men in deze hypotheses een zeker patroon, wat uiteindelijk in 1925 resulteerde in het formuleren van de zogenaamde kwantummechanica. Het atomaire gedrag van materie bleek goed te beschrijven en te verklaren te zijn. De klassieke wetten uit de macroscopische fysische wereld waren wel juist, maar niet op zeer kleine schaal, de aarde en de mens zijn heel erg groot en heel erg zwaar ten opzichte van de kwantummechanische wetten (die gelden op atomaire schaal).
De veranderde denkwijze kwam neer op:
- Energie bestaat uit pakketjes, kwanta.
- De hoeveelheid energie van een pakketje (kwantum) bij een meting aan een bepaald verschijnsel is altijd hetzelfde.
- Een pakketje straling kan men beschouwen als golf of als deeltje.
- Kleine deeltjes bezitten tevens een golfkarakter.
(Dit betekent bijvoorbeeld, dat als u uw dimmer omhoog draait om meer licht in de woonkamer te krijgen, de energiecurve van het licht niet als een continue functie zal stijgen, maar stapsgewijs.)
Zwarte straling
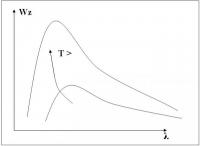 -fig 2- Stralingcurve
-fig 2- StralingcurveIn de ruimte binnen een holle, warme, vaste stof is continue elektromagnetische straling aanwezig, omdat er voortdurende emissie- en absorptie-processen plaatsvinden. De ruimte bezit een zekere energiedichtheid. Deze energiedichtheid kunnen we meten wanneer we in de holle vaste stof een klein gaatje gemaakt hebben, dat de binnenruimte met de buitenwereld verbindt. Door dit gaatje ontsnapt een klein deel van de straling naar buiten. Langs de klassieke weg kan bewezen worden dat de energie van de door het gat naar buiten geëmitteerde straling Wz, evenredig is met de stralingsdichtheid W binnen de holte.
De uitgezonden straling noemt men zwarte straling, omdat het vlakje dat de straling emitteert (het gat) als een vlak van een zogenaamd 'zwart lichaam' beschouwd kan worden. Een zwart lichaam is een lichaam dat alle opvallende straling absorbeert, en dus geen straling reflecteert. Wanneer men het verloop van Wz als functie van golflengte λ (de spectrale verdeling) bekeek, vond men:
[OLIST]Wz is onafhankelijk van het materiaal waaruit het holle lichaam bestaat.
Wz is uitsluitend afhankelijk van de temperatuur.[/OLIST]
Klassieke verklaring
 -fig 3- voorbeeld van een staande golf, bij de knoop (X=0) is de amplitude altijd nul
-fig 3- voorbeeld van een staande golf, bij de knoop (X=0) is de amplitude altijd nulDe totale energie van de straling is de som van alle staande golven. De formule voorspelt de energie w van het systeem als functie van de frequentie van de straling f en de temperatuur T:
- aantal staande golven N = 8π f² V / c³
- w(f)df = 4π k T/ (c²) f² df
Voor lage frequenties verklaarde dit de experimentele gegevens goed, maar naarmate de frequentie hoger werd, bleek het steeds meer in strijd met de experimentele werkelijkheid. Wanneer de frequentie f naar oneindig zou gaan, gaat w(f)df eveneens naar oneindig. Dit zou leiden tot de zogenaamde ultraviolet catastrofe: een ideaal zwart lichaam in thermisch evenwicht zou straling met oneindige kracht uitzenden. Bovengenoemd experiment bewijst dat dit niet het geval is, voor hele hoge frequentie's (lage golflengte λ) daalt de grafiek van Wz voorbij een zekere waarde van λ.
Max Planck
De Duitse natuurkundige Max Planck voerde nu in 1900 een ad hoc hypothese in, die geheel in strijd was met de klassieke fysica. Hij stelde namelijk dat de energie van een harmonisch trillend systeem met frequentie f, niet elke waarde aan kon nemen, maar alleen veelvouden de waarde hf (of hν). Het bleek dat een dergelijke aanname de experimentele waarheid volledig bleek te beschrijven als voor h de waarde 6,63 10-34 gekozen werd, de constante van Planck.
Kwantum
Wat Planck dus deed, was de energie niet als een continuüm opvatten, maar als een gekwantiseerde grootheid. Door slechts één overeenkomst tussen theorie en experiment was de kwantisatie-hypothese nog niet bewezen, het bracht geen revolutie teweeg in de wereld van fysici in die tijd. Men zag het eerder als een curiositeit, een kwestie van toeval, en men veronderstelde dat de spectrale verdeling uiteindelijk toch wel van de klassieke wetten af te leiden zou zijn.Pas toen meer verschijnselen niet klassiek maar wel met de kwantisatie-hypothese verklaard bleken te kunnen worden, begon men in te zien dat hier misschien toch wel van iets wezenlijks sprake zou kunnen zijn. Ook het foto-elektrisch effect en het thermisch gedrag van stoffen bij lage temperaturen lieten zich prima beschrijven door deze hypothese. Het zou leiden tot een ommekeer in het denken van natuurkundigen en het formuleren van de kwantummechanica in 1925.