Osmium: Het element
 Osmium is in 1803 ontdekt door Smithson Tennant in Londen. Het metaal bleef met iridium achter als residu na het oplossen van platinaerts in koningswater. De naam osmium is afgeleid van het Griekse osmè, dat stank betekent. Osmium tetraoxide, verspreidt een enorme stank. Osmium is de zeldzaamste stabiele element: de aardkorst bevat ongeveer 1 gram per 200 ton. Osmium wordt heden verkregen als bijproduct van de winning van nikkel en platina. De wereldwijde productie is slechts 500 kilo. Osmium is het dichtste metaal, specifiek gewicht 22,587 g/cm3 bij 20 °C en is samen met diamant de hardste stof. Osmium kan elf oxidatie toestanden aannemen, van -2 tot +8; alleen enkele overgangsmetalen vertonen deze eigenschap.
Osmium is in 1803 ontdekt door Smithson Tennant in Londen. Het metaal bleef met iridium achter als residu na het oplossen van platinaerts in koningswater. De naam osmium is afgeleid van het Griekse osmè, dat stank betekent. Osmium tetraoxide, verspreidt een enorme stank. Osmium is de zeldzaamste stabiele element: de aardkorst bevat ongeveer 1 gram per 200 ton. Osmium wordt heden verkregen als bijproduct van de winning van nikkel en platina. De wereldwijde productie is slechts 500 kilo. Osmium is het dichtste metaal, specifiek gewicht 22,587 g/cm3 bij 20 °C en is samen met diamant de hardste stof. Osmium kan elf oxidatie toestanden aannemen, van -2 tot +8; alleen enkele overgangsmetalen vertonen deze eigenschap.
Algemeen
 Periodiek systeem. Osmium atoomnummer 76. / Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
Periodiek systeem. Osmium atoomnummer 76. / Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0) Osmium kristallen / Bron: Alchemist-hp (www.pse-mendelejew.de), Wikimedia Commons (FAL)
Osmium kristallen / Bron: Alchemist-hp (www.pse-mendelejew.de), Wikimedia Commons (FAL)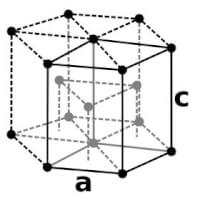 Osmium hexagonale atoomrooster / Bron: Matthias Svete and Offnfopt, Wikimedia Commons (Publiek domein)
Osmium hexagonale atoomrooster / Bron: Matthias Svete and Offnfopt, Wikimedia Commons (Publiek domein)| Naam | Symbool | Atoomnummer | Groep | periode | Blok | Reeks | Kleur |
|---|---|---|---|---|---|---|---|
| Osmium | Os | 76 | Platina groep IJzer • Kobalt • Nikkel Ruthenium • Rhodium • Palladium Osmium • Iridium • Platina Hassium • Meitnerium • Darmstadtium | Periode 6 | D blok | Overgangsmaterialen | Blauwgrijs |
Chemische eigenschappen Osmium
| Atoommassa (u) | Elektronen configuratie | Oxidatietoestand | Elektro negativiteit (Pauling) | Atoom straal (pm) | 1e ionisatie potentiaal (KJ/mol) |
|---|---|---|---|---|---|
| 190,2 | [Xe]4f14 5d6 6s2 | +3,+4 | 2,2 | 135 | 840 |
Fysische eigenschappen Osmium
| Dicht- heid (kg/m3) | Hard- heid (Mohs) | Smelt- punt (°C) | Kook- punt (°C) | Smelt- warmte (KJ/mol | Verdampings- warmte (KJ/mol) | Kristal- structuur | Specifieke warmte (J/kg°C) | Elektrische weerstand (μΩ•cm) | Warmte geleiding (W/m°C) |
|---|---|---|---|---|---|---|---|---|---|
| 22610 | 7,1 | 3035 | 5127 | 31,8 | 746 | Hexagonaal | 130 | 9,5 | 88 |
Gebruikers eigenschappen van osmium
In metallische vorm is osmium een bros breekbaar blauw getint glanzend metaal met grote dichtheid. In poedervorm reageert het met zuurstof en vormt daarbij het giftige stinkende osmiumtetraoxide. Osmium is het element met de hoogste dichtheid. Van alle metalen uit de platinagroep heeft osmium het hoogste smeltpunt en de laagste dampdruk. De meest voorkomende oxidatietoestanden zijn +3 en +4, maar +1 en +8 komen ook voor.Toepassingen van osmium
In contact met zuurstof gaat osmium over in het giftige en stinkende osmium(VIII)oxide. Osmium wordt vrijwel alleen in legeringen toegepast en v.n.l. als hardheid en slijtvastheid belangrijk zijn, zoals voor slijvaste corrosievaste onderdelen zoals de punten van dure balpennen en vulpennen, platenspeler naalden, stopcontacten en andere voorwerpen waarin slijtage en wrijving minimaal moet zijn.In de organische chemie wordt osmium(VIII)oxide als oxidator gebruikt. De belangrijkste osmium verbinding is tetroxide OsO4, een kleurloze vaste stof gebruikt in de vingerafdruk detectie. Osmiumtetroxide wordt gebruikt als katalysator bij de aanmaak van medicijnen als: anti-obesitas en antidiabetica. Voor implantaten zoals pacemakers worden legeringen van 90% platina en 10% osmium gebruikt. Uit de verhouding van 187 Os en 188 Os bepaalt men de ouderdom van gesteente en meteorieten.
De meest stabiele isotopen van Osmium
| Isotoop | Ra(%) | Halveringstijd | Verval | VE(MeV) | Vervalproduct |
|---|---|---|---|---|---|
| 184 Os | 0,02 | 5,6 10.↑13 jaren | alfa | 1,671 | 180W |
| 185 Os | Synthetisch | 93,6 dagen | EV | 1,013 | 185Re |
| 186 Os | 1,58 | 12,0.10↑15 jaren | alfa | 2,822 | 182W |
| 187 Os | 1,6 | Stabiel met 111 neutronen | -- | --- | --- |
| 188 Os | 13,3 | Stabiel met 112 neutronen | --- | --- | --- |
| 189 Os | 16 | Stabiel met 113 neutronen | --- | --- | --- |
| 190 Os | 26,4 | Stabiel met 14 neutronen | --- | --- | --- |
| 191 Os | Synthetisch | 15,4 dagen | Beta | 0,314 | 191Ir |
| 192 Os | 41 | Stabiel met 116 neutronen | --- | --- | --- |
| 193 Os | Synthetisch | 30,11 uren | beta | 1,14 | 193 Ir |
| 194 Os | Synthetisch | 6 jaar | beta | 0,097 | 194 Ir |
In de natuur komen 7 osmiumisotopen voor waarvan er 5 stabiel zijn en 2 radioactief. Deze radioactieve isotopen hebben extreem lange halveringstijden en dus praktisch gezien stabiel zijn.
Voorkomen van osmium
Osmium wordt oa. aangetroffen in, in de natuur voorkomende, legering iridiosmium(legering van iridium en osmium) welke voorkomt in de Oeral en in Noord- en Zuid-Amerika. In Ontario in Canada wordt osmium aangetroffen in nikkelmijnen samen met andere metalen uit de platinagroep. Momenteel wordt osmium gewonnen tijdens de verwerking van platina en nikkel ertsen.Milieu en gezondheid
- Metallisch osmium is onschadelijk, maar als het met zuurstof reageert en daarbij het extreem giftige osmiumtetraoxide vormt, is osmium zeer schadelijk. Zelfs bij zeer lage concentraties kan osmiumtetraoxide ernstige schade aanrichten in de longen, huid en ogen.
- In metaalvorm is osmium blauw-wit, zeer hard, broos. Poedervormig osmium is makkelijker te maken, maar het veroorzaakt osmium tetroxide (OsO4) uitstoot als het wordt blootgesteld aan lucht. osmium teroxide stinkt erg en is zeer giftig.
- Osmium tetroxide, OsO4, is zeer giftig. In lucht kunnen concentraties vanaf 10-7 g/m3 al effecten veroorzaken als verstopte longen en schade aan de ogen.
- Osmiumtetraoxide wordt in het lichaam worden opgenomen door inademing van dampen en door inslikken. Luchtverontreiniging met osmium kan een schadelijke concentratie aannemen door verdamping van de stof bij kamertemperatuur. De stof ontbindt bij verhitting, en osmium dampen ontstaan. De stof is een sterke oxidant en reageert met brandbare materialen. Het reageert met zoutzuur tot giftige gassen. Het vormt instabiele verbindingen met alkalimetalen. Inademing van de stof kan longoedeem veroorzaken, inademing geeft een brandend gevoel, kuchen, hoofdpijn, kortademigheid, onrust. Huid: roodheid, verbranding, pijn, verkleuring, blaren. Ogen: roodheid, pijn, onscherp gezichtsvermogen, blindheid, ernstige verbrandingen. Bij inslikken ontstaan maagkrampen, brandend gevoel, shock of flauwvallen.
- Langdurig huidcontact met osmium kan dermatitis veroorzaken.
- De ecotoxociteit van osmium is laag, het is een krachtige oxidant, het wordt omgezet in ongevaarlijke dioxide.
Richtprijs
Osmium wordt meestal aangeboden als 99.9% zuiver poeder. De prijs in 2012 was circa $400 per troy ounce (dat is ongeveer $13.000 per kilogram), afhankelijk van “vraag en aanbod” en de zuiverheid.© 2014 - 2025 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Elementen en metalenWeetjes en wetenswaardigheden. Wat is een element? Welk element komt het meeste voor? Welk element werd als eerste in de…
Elementen en metalenWeetjes en wetenswaardigheden. Wat is een element? Welk element komt het meeste voor? Welk element werd als eerste in de…
 Rhenium: Het elementRhenium (Re) ontdekt in 1925, rhenium (van de rivier de Rhine) is een zilverachtig-wit, zware overgangsmetaal (groep 7,…
Rhenium: Het elementRhenium (Re) ontdekt in 1925, rhenium (van de rivier de Rhine) is een zilverachtig-wit, zware overgangsmetaal (groep 7,…
 De vulpen, hoe populair is hij nog?De vulpen is een pen met vloeibare inkt. Een belangrijk verschil met de balpen is dat de vulpen rechtstreeks te vullen i…
De vulpen, hoe populair is hij nog?De vulpen is een pen met vloeibare inkt. Een belangrijk verschil met de balpen is dat de vulpen rechtstreeks te vullen i…
 Rhodium: Het elementRhodiumis is een van de zeldzaamste en meest kostbare edelmetalen. Het is zeer corrosievast. Het wordt gevonden in plati…
Rhodium: Het elementRhodiumis is een van de zeldzaamste en meest kostbare edelmetalen. Het is zeer corrosievast. Het wordt gevonden in plati…
 Thallium: Het elementThallium (van Grieks: groene tak, vanwege de groene emissielijn in het spectrum) is in 1861 ontdekt door Sir William Cro…
Thallium: Het elementThallium (van Grieks: groene tak, vanwege de groene emissielijn in het spectrum) is in 1861 ontdekt door Sir William Cro…
 Barium: Het elementBarium is in 1774 geïdentificeerd door Carl Wilhelm Scheele en in 1808 geïsoleerd door Humphry Davy door elektrolyse van…
Barium: Het elementBarium is in 1774 geïdentificeerd door Carl Wilhelm Scheele en in 1808 geïsoleerd door Humphry Davy door elektrolyse van…
Gerelateerde artikelen
Bronnen en referenties
- http://webelements.com/
- Copyright 1993-2014 Mark Winter [The University of Sheffield and WebElements Ltd, UK]. l
- http://www.lenntech.nl/periodiek/elementen/os.htm#ixzz34o1Ofeio
- http://nl.wikipedia.org/wiki/Osmium
- http://chemistry.about.com/od/metalsalloys/ig/Metal-Crystals-Photo-Gallery/Osmium-Crystals.htm
- http://www.nature.com/nchem/journal/v4/n11/full/nchem.1479.html
- Afbeelding bron 1: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 2: Alchemist-hp (www.pse-mendelejew.de), Wikimedia Commons (FAL)
- Afbeelding bron 3: Matthias Svete and Offnfopt, Wikimedia Commons (Publiek domein)
Custor (173 artikelen)
Laatste update: 10-02-2017
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 9
Laatste update: 10-02-2017
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 9
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.