Jodium: het element
 Het element werd in 1811 ontdekt door de Franse wetenschapper Bernard Courtois. De naam is afkomstig van het Griekse Iodes, wat violet betekent. Jodium is al zeer lang zeer bekend vanwege zijn desinfecterend vermogen. Jodium is onontbeerlijk voor de gezondheid van de mens, het maakt deel uit van het hormoon thyroxine, een schildklierhormoon dat mede verantwoordelijk is voor lichamelijke en geestelijke welzijn. Jodium is vast bij kamertemperatuur, maar smelt bij verwarming en dan vormt zich direct(sublimatie) de bekende dichte, violette damp.
Het element werd in 1811 ontdekt door de Franse wetenschapper Bernard Courtois. De naam is afkomstig van het Griekse Iodes, wat violet betekent. Jodium is al zeer lang zeer bekend vanwege zijn desinfecterend vermogen. Jodium is onontbeerlijk voor de gezondheid van de mens, het maakt deel uit van het hormoon thyroxine, een schildklierhormoon dat mede verantwoordelijk is voor lichamelijke en geestelijke welzijn. Jodium is vast bij kamertemperatuur, maar smelt bij verwarming en dan vormt zich direct(sublimatie) de bekende dichte, violette damp.
 Periodiek systeem van elementen. Jodium atoomnummer 53 / Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
Periodiek systeem van elementen. Jodium atoomnummer 53 / Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0) Jodium vast / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)
Jodium vast / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein) Jodium damp / Bron: Matias Molnar, Wikimedia Commons (CC BY-SA-3.0)
Jodium damp / Bron: Matias Molnar, Wikimedia Commons (CC BY-SA-3.0)Plaats van jodium in het periodiek systeem
Jodium of jood is een scheikundig element met symbool I en atoomnummer 53. Het element behoort tot de groep van de halogenen. Als enkelvoudig element komt, net als de andere halogenen, jodium niet in de natuur voor maar in moleculen van twee jodiumatomen (di-jood, I-2).Algemene eigenschappen van het element jodium
| naam | Symbool | Atoomnummer | Groep | Periode | Blok | Reeks | Kleur |
|---|---|---|---|---|---|---|---|
| Jodium, Jood, Iodium | I | 53 | Halogenen | periode 5 | P-blok | Halogenen | violet |
Chemische eigenschappen van het element jodium
| Atoommassa (u) | Elektronen configuratie | Oxidatie toestanden | Elektro negativiteit (Pauling) | Atoomstraal (pm) | Ionisatie potentiaal (KJ/mol) |
|---|---|---|---|---|---|
| 126,9045 | [Kr]4d10 5s2 5p5 | -1, +1, +5, +7 | 2,66 | 133 | 1e: 1008 2e: 1845 3e: 3184 |
Fysische eigenschappen van het element jodium
| Dicht heid (kg/m3) | Smelt punt (K) | Kook punt (K) | Aggregatie toestand | Smelt warmte (kJ/mol) | Verdampings warmte (kJ/mol) | Specifieke warmte (J/kg.K) | Elektrische weerstand (μ.Ω.cm) | Warmte geleiding (W/m1.K) | Kristal structuur |
|---|---|---|---|---|---|---|---|---|---|
| 4930 | 387 | 458 | vast | 7,82 | 20,75 | 214 | 1,3x10↑15 | 0,45 | Ortho |
Isotopen van jodium
Er is een stabiele jodiumisotoop 127- I en circa 30 radioactieve isotopen. De synthetische isotoop 131- I met een halveringstijd van 8 dagen wordt toegepast in kankeronderzoek en bij behandeling van te snel werkende schildklieren. De isotoop 125- I wordt toegepast in de radiotherapie voor zeer plaatselijke behandeling, waarbij meerdere kleine bronnen worden geïmplanteerd ter plaatse van het gezwel, bijvoorbeeld in de prostaat.De isotoop 129- I met een halveringstijd van 15 miljoen jaar ontstaat uit het verval van 129 Xe in de atmosfeer en tijdens uraniumsplijting.
De stabielste isotopen van jodium
| Isotoop | RA(%) | Halveringstijd | Verval via | VE(MeV) | Vervalproducten |
|---|---|---|---|---|---|
| 125-I | Synthetisch | 59,4 dagen | EV | 0,168 | 125Te |
| 127-I | 100 | Stabiel met 74 neutronen | |||
| 129-I | Synthetisch | 1,57x10↑7 jaar | beta- | 0,194 | 129Xe |
Het voorkomen van jodium
Anorganische jodiumverbindigen
Halogenen vormen met veel andere elementen verbindingen(halogeniden), dat geldt ook voor jodium(jodiden). Het vormt ook verbindingen met andere halogenen, zoals joodmonochloride (ICl), joodtrichloride (ICl3), joodpentafluoride (IF5) en joodheptafluoride (IF7). Jodium reageert actief met alkali- en aardalkalimetalen.Organische jodiumverbindingen
Organische joodverbindingen worden veel toegepast. Voorbeelden zijn: Joodmethaan, Jodoform. Joodazijnzuur, de schildklierhormonen thyroxine en tri-jodothyronine, en Erythrosine een synthetische kleurstof.Toepassingen van jodium en zijn verbindingen
- In een mengsel van water en ethanol opgelost wordt jodium gebruikt voor het ontsmetten van wonden. Veel medicijnen en schoonmaakmiddelen voor oppervlakkige wonden bevatten jood. Jodiumtinctuur heeft een desinfecterende werking, de oplossing bevat 2,0% jood, 2,5% natrium- of kaliumjodide en 48,0% alcohol. Jodium wordt aan gezichtszeep en verbandmateriaal toegevoegd.
- Thyroxine, een jodiumbevattend schildklierhormoon, wordt gebruikt in de geneeskunde. Ter preventie van schildklierhypertrofie wordt aan keukenzout jodide toegevoegd (jozozout). Aan bakkerszout dat in brood gebruikt wordt, wordt kaliumjodide toegevoegd. Het voedingscentrum stelt dat voor een volwassene elke dag 150 tot 300 microgram jodium nodig is om schildklier problemen (struma) te voorkomen; voor kinderen gelden lagere doses.
- Bij schimmel- en gistinfecties werkt kaliumjodide goed. Jodiumtabletten (kaliumjodide) worden aan mensen in een kernrampgebied gegeven om opname van radioactief jodium te verhinderen door de schildklier te verzadigen met ongevaarlijk jodium, waardoor er geen ruimte is voor radioactief jodium.
- Kaliumjodide wordt gebruikt in de fotografie bij het ontwikkelen van foto's.
- Door met vliegtuigen kleine kristallen zilverjodide (AgI) in de atmosfeer te brengen die werken als condensatie kiemen ontstaan waterdruppels, regen in een een tijd van droogte.
- Wanneer men jodiumoplossing en een zetmeeloplossing samen brengt ontstaat er jodium-zetmeelamylose, met een blauwe kleur. Jodium wordt vanwege die verkleuring gebruikt als indicator om zetmeel aan te tonen.
- Jodium (of waterstofjodide) wordt gebruikt in (illegale) drugs laboratorium bij de productie van methamfetamine.
- Jodium is een bestanddeel van waterzuiveringstabletten die gebruikt worden bij de drinkwaterbereiding.
- De halogeenlamp is in principe een gewone (wolfraam)gloeilamp. Aan het inerte gas in de lamp is een halogeenverbinding (bijvoorbeeld methyljodide) toegevoegd. De lichtopbrengst verdubbelt zich ten opzicht van een gewone gloeilamp en de levensduur wordt vijf keer langer. De verklaring is dat bij hoge temperatuur (circa 3.000 °C) een weinig van het wolfraammetaal verdampt. In het koudere gedeelte van de lamp reageert dat wolraamdamp met de jodiumdamp tot wolfraamjodide dat in dampvorm blijft; bij de hete wolfraam gloeidraad ontleedt de damp weer in wolfraam en jodium. Het wolfraam slaat weer neer op de wolfraamspiraal. Dit proces herhaalt zich waardoor wolfraam verlies steeds weer wordt aangevuld, wat de vijfmaal langere levensduur verklaart. Dit proces kan ook met andere halogenen worden uitgevoerd.
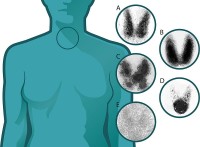 A normale schildklier- B Ziekte van Graves - C Plummers desease - D Toxische adenoom - E Thyreoïditis / Bron: Petros Perros, Wikimedia Commons (CC BY-SA-3.0)
A normale schildklier- B Ziekte van Graves - C Plummers desease - D Toxische adenoom - E Thyreoïditis / Bron: Petros Perros, Wikimedia Commons (CC BY-SA-3.0)Jodium en de schildklier
- Jodium is een bouwstof van de schildklierhormonen, essentieel voor groei, zenuwstelsel en stofwisseling. Het menselijk lichaam bevat gemiddeld 10-15 mg jodium, deels in de schildklier opgeslagen. De dagelijks aanbevolen hoeveelheid jodium ligt volgens de wereldgezondheidsorganisatie tussen 150 en 200 μg.
- De radioactieve jodium isotopen 123- I en 131- I worden gebruikt bij behandeling en diagnose van aandoeningen in de schildlklier. De zwakke gammastraler 123- I heeft diagnostische toepassingen. Het isotoop 131- I, een sterkere gammastraler, wordt zowel diagnostisch als therapeutisch gebruiktt. Beide isotopen worden toegediend als verbindingen die zich integreren in het groeiregelingshormoon in de schildklier.
- Bij tekort aan jood vertraagt de schildklierfunctie en zwelt de schildklier op(struma). Grote hoeveelheden jood kan schadelijk zijn; de schildklier gaat te snel werken en veroorzaakt verstoorde hartritmes en gewichtsverlies. Mensen reageren op te grote hoeveelheden jood met jodisme: dat kan jeuken, bronchitis, slaapstoornissen, en uitslag inhouden. Kinderen zijn gevoelig voor een te hoge of te lage jodiumgehalte.
- Jozozout: Geadviseerd wordt een dagelijkse opname van circa 0,1 mg jodium Jodiumrijk voedsel is zeevis, schelp- en schaaldieren, eieren, melk, vlees en granen. Jood maakt deel uit van de schildklier die hormonen produceert die nodig zijn voor een goede werking van het metabolisme van alle cellen. Een tekort aan jodium kan leiden tot struma, en andere aandoeningen, zoals vertraging van de (hersen)groei bij jonge kinderen. Om dit te voorkomen voegt men jodium toe aan keukenzout (jozozout).
Milieu-effecten van Jodium
- Normaal komen mensen eigenlijk nooit in aanraking met radioactief jood, of ze moeten er mee werken of om medische reden mee behandeld worden.
- Het komt niet als element voor, maar als Jodium2-molecuul, of als verbinding met andere elementen.
- Jodium zit in de lucht, in het water en in de bodem. Oceanen zijn belangrijke bronnen van jodium. Jodium hecht zich in de bodem aan organisch materiaal en kan langere tijd op dezelfde plaats blijven. Planten die op deze bodem groeien, nemen jood op, waardoor het in de voedselketen terecht komt. Door fossiele brandstoffen komt er jodium in de atmosfeer terecht. De hoeveelheid die door menselijke activiteit in de lucht terecht komt is klein in vergelijking met de hoeveelheid die vanuit de oceanen verdampt en elders weer neer komt.
- Door chemische reacties in de atmosfeer worden er radioactieve joodisotopen gevormd, de meeste hebben zeer korte halveringstijden en veranderen snel in stabiele mengsels.
- Jood-131 is een radioactieve isotoop met een halfveringstijd van miljoenen jaren en is een bedreiging voor het milieu. Deze isotoop komt via kerncentrales, waar het gevormd wordt tijdens de verwerking van uranium en plutonium, in de lucht terecht. Ongevallen in kerncentrales hebben de uitstoot van grote hoeveelheden radioactief jood als gevolg.Voorbeeld voor de effecten die radioactief jood veroorzaken, is het ongeluk in de kerncentrale van Chernobyl in 1986. Hierbij kwam 131-I vrij. Het isotoop heeft een halveringstijd van acht dagen, maar het kan van grazende dieren opgenomen worden en op deze manier in melk- en watervoorraden van de mens terechtkomen. Jood 131 is een van de radionucleotiden die betrokken is bij atmosferische testen van nucleaire wapens. Deze zijn begonnen in 1945 en geëindigd in 1980. Jood 131 is een van de radionucleotiden met een lange halfveringstijd. Het zal eeuwenlang aanwezig blijven in het milieu en doet de kans op kanker en andere ziekten als schildklierafwijkingen en hormoonstoornissen toenemen.
- Bruinalgen, koralen, marine sponsen, schelpen en vissen bevatten hoge concentraties aan jood in vorm van thyroxine of tri-joodthyronine.
- Als jood in oppervlaktewateren terechtkomt, kan het als joodgas weer vrijkomen. Joodverbindingen zijn in het algemeen goed oplosbaar in water of alcohol.
- Andere mogelijkheden zijn het verweren van joodhoudende rotsen en vulkanische activiteiten.
- Via het afvalwater kunnen deze stoffen, en ook geneesmiddelen in het grondwater terechtkomen. Vaak komt jood uit afvalwaterzuiveringsinstallaties in oppervlaktewateren terecht. Dit kan ook voor radioactieve isotopen gelden. Jood kan in hogere concentraties bij vuilstortplaatsen voorkomen.
- Wereldwijd is de jood opname heel verschillend, mensen in gebieden waar men veel vis eet, nemen veel jood op, tot wel 10 mg per dag.
- Jodium kan de huid verbranden en ogen en slijmvliezen beschadigen. Zuiver jodium is zeer giftig wanneer het wordt ingenomen.
- Huidcontact met geconcentreerd jood kan leiden tot pigmentveranderingen. Jood dampen veroorzaken irritatie van ogen en long.
© 2014 - 2024 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Meitnerium: Het elementMeitnerium is een scheikundig element met symbool Mt en atoomnummer 109. Het is een zeer radioactief synthetische elemen…
Meitnerium: Het elementMeitnerium is een scheikundig element met symbool Mt en atoomnummer 109. Het is een zeer radioactief synthetische elemen…
 Scheikunde - Periodiek systeem'Periodiek systeem' in scheikunde is een begrip dat vaak wordt gebruikt. Op het scheikunde-examen bijvoorbeeld komt dit…
Scheikunde - Periodiek systeem'Periodiek systeem' in scheikunde is een begrip dat vaak wordt gebruikt. Op het scheikunde-examen bijvoorbeeld komt dit…
 Lawrencium: Het elementLawrencium is een synthetisch chemisch element met een chemisch symbool Lr en atoomnummer 103. Het is een radioactief me…
Lawrencium: Het elementLawrencium is een synthetisch chemisch element met een chemisch symbool Lr en atoomnummer 103. Het is een radioactief me…
 Copernicium: Het elementCopernicium is synthetisch gemaakt in 1996, door Peter Armbruster and Gottfried Münzenber (Gesellschaft fur Schwerionenf…
Copernicium: Het elementCopernicium is synthetisch gemaakt in 1996, door Peter Armbruster and Gottfried Münzenber (Gesellschaft fur Schwerionenf…
 Systematische naamgeving van koolstofverbindingenOm communicatie te vereenvoudigen, wordt binnen de scheikunde gebruik gemaakt van bepaalde regels bij het benoemen van e…
Systematische naamgeving van koolstofverbindingenOm communicatie te vereenvoudigen, wordt binnen de scheikunde gebruik gemaakt van bepaalde regels bij het benoemen van e…
 Polonium: Het elementPolonium is een zeldzaam zeer radioactief element zonder stabiele isotopen, het element komt voor in uraniumertsen. Polo…
Polonium: Het elementPolonium is een zeldzaam zeer radioactief element zonder stabiele isotopen, het element komt voor in uraniumertsen. Polo…
Gerelateerde artikelen
Bronnen en referenties
- https://en.wikipedia.org/wiki/Iodine
- http://www.lenntech.nl/periodiek/water/jodium/jood-en-water.htm
- http://sciencenotes.org/?attachment_id=341(afbeelding: Jodium embleem)
- http://nl.wikipedia.org/wiki/Jodium
- http://news.nost.jp/2010/12/zeldzame-en-schaarse-metalen/
- Afbeelding bron 1: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 2: Benjah bmm27, Wikimedia Commons (Publiek domein)
- Afbeelding bron 3: Matias Molnar, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 4: Petros Perros, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 5: Drahreg01, Wikimedia Commons (GFDL)
Custor (173 artikelen)
Laatste update: 20-02-2017
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 10
Laatste update: 20-02-2017
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 10
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.
 Jood-131 opgeslagen in loden vaten /
Jood-131 opgeslagen in loden vaten /