Permanganometrie: redoxtitraties met kaliumpermanganaat
 Permanganometrie is een verzamelnaam voor redoxtitraties waarbij als titrant kaliumpermanganaat wordt gebruikt. In water dissocieert kaliumpermanganaat in kalium- en permanganaat-ionen. De permanganaat-ionen geven aan de oplossing hun typische intens paarse kleur. Het permanganaat-ion is een sterke oxidator en is dus uiterst geschikt om de concentratie van oplossingen van reductoren te bepalen. Bij reductie van het permanganaat-ion verliest het zijn paarse kleur wat zeker in weinig gekleurde oplossingen een eenvoudige waarneming van het equivalentiepunt toelaat. Het vervult tijdens een redoxtitratie dus naast zijn titrant- ook een indicatorfunctie.
Permanganometrie is een verzamelnaam voor redoxtitraties waarbij als titrant kaliumpermanganaat wordt gebruikt. In water dissocieert kaliumpermanganaat in kalium- en permanganaat-ionen. De permanganaat-ionen geven aan de oplossing hun typische intens paarse kleur. Het permanganaat-ion is een sterke oxidator en is dus uiterst geschikt om de concentratie van oplossingen van reductoren te bepalen. Bij reductie van het permanganaat-ion verliest het zijn paarse kleur wat zeker in weinig gekleurde oplossingen een eenvoudige waarneming van het equivalentiepunt toelaat. Het vervult tijdens een redoxtitratie dus naast zijn titrant- ook een indicatorfunctie.
- Reductiemogelijkheden van MnO4-
- Redoxkoppel 1: MnO4-/Mn2+
- Redoxkoppel 2: MnO4-/MnO2
- Redoxkoppel 3: MnO4-/MnO42-
- Verband met de pH
- Concentratiebepalingen aan de hand van permanganometrie
- In zuur milieu
- In neutraal milieu
- In basisch milieu
- E°(MnO4-/Mn2+) versus E°(MnO2/Mn2+)
- KMnO4 is geen oertiterstof
- Standaardisatie van een KMnO4-oplossing
- Uitgewerkt voorbeeld van een permanganometrische bepaling
Reductiemogelijkheden van MnO4-
Het MnO4--ion kan deel uitmaken van drie redoxkoppels. Het kan dus op drie manieren worden gereduceerd, namelijk door de opname van 5, 3 of 1 e-. Hierbij kan het worden omgezet in drie mogelijke geconjugeerde reductoren: het mangaan-ion (Mn2+), mangaandioxide (MnO2) of het manganaat-ion (MnO42-).Redoxkoppel 1: MnO4-/Mn2+
Voor de omzetting in het mangaan-ion moet het permanganaat-ion 5e- opnemen. De halfreactie kan als volgt worden geschreven.MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
De normpotentiaal van dit koppel E°(MnO4-/Mn2+) heeft als waarde 1.507V
Deze potentiaal geldt bij cH+ = 1 mol/L en dus bij een pH van 0. Ook de concentraties van de andere stoffen zijn onder normomstandigheden gelijk aan 1 mol/L. Om de redoxpotentiaal bij andere omstandigheden te bepalen, dient deze berekend te worden volgens de vergelijking van Nernst.
E = 1.507V + 0.059/5 × log ((cMnO4- × cH+8) / (cMn2+ × cH2O4))
Redoxkoppel 2: MnO4-/MnO2
Voor de omzetting tot mangaandioxide moet het permanganaat-ion 3e- opnemen. De halfreactie kan als volgt worden geschreven.MnO4- + 3e- +4H+ = MnO2 +2H2O
De normpotentiaal van dit koppel E°(MnO4-/MnO2) heeft als waarde 1.679V. Om de redoxpotentiaal bij andere omstandigheden te bepalen, dient deze berekend te worden volgens de vergelijking van Nernst.
E = 1.679V + 0.059/3 × log((cMnO4- × cH+4) / (cMnO2 × cH2O2))
Redoxkoppel 3: MnO4-/MnO42-
Voor de omzetting tot het manganaat-ion moet het permanganaat-ion 1 e- opnemen. De halfreactie kan als volgt worden geschreven.MnO4- + e- = MnO42-
Deze halfreactie is onafhankelijk van de pH van het reactiemilieu. De normpotentiaal van dit koppel E°(MnO4-/MnO42-) heeft als waarde 0.540V. Om de redoxpotentiaal bij andere concentraties aan MnO4- en MnO42- te kennen, dient deze te worden berekend met de vergelijking van Nernst.
E = 0.540V + 0.059 × log(cMnO4- / cMnO42-)
Verband met de pH
Welke omzetting er zal gebeuren, hangt af van de pH van het reactiemilieu. Bij een lage pH (zuur milieu) zal vooral de eerste reductie doorgaan, in licht zuur tot neutraal milieu de tweede en bij hoge pH de laatste. Het verschil in omzetting is visueel waarneembaar. Mn2+ is een kleurloos ion, MnO2 is een bruine neerslag en MnO42- heeft een groene kleur.Concentratiebepalingen aan de hand van permanganometrie
Het permanganaat-ion is uiterst geschikt als titrant voor de titrimetrische bepaling van een reductor-oplossing met onbekende concentratie. Een titrimetrische bepaling vraagt immers een aflopende titratiereactie en daar het permanganaat-ion een groot oxiderend vermogen heeft, zal het met vele reductoren een aflopende redoxreactie vertonen.Wanneer een kaliumpermanganaatoplossing met een gekende concentratie wordt toegedruppeld aan een oplossing met een onbekende concentratie aan een bepaalde reductor, dan zal kaliumpermanganaat reageren met deze reductor. Wanneer alle aanwezige reductormoleculen in het reactiemengsel zijn weggereageerd, dan zal door de intens paarse kleur van de nu in overmaat zijnde permanganaat-ionen de kleur van het reactiemengsel drastisch veranderen. Het equivalentiepunt (EP) is dus visueel waarneembaar zonder de noodzaak van een externe indicator.
In zuur milieu
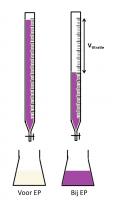 zuur milieu
zuur milieuIn neutraal milieu
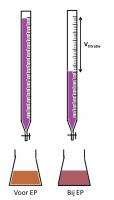 neutraal milieu
neutraal milieuIn basisch milieu
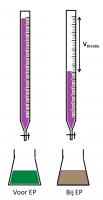 basisch milieu
basisch milieuOmdat permanganometrie in zuur milieu het meest duidelijke equivalentiepunt geeft, zal deze techniek dan ook het meest worden toegepast bij lage pH. Om het zure milieu of de lage pH te bereiken, wordt meestal een hoeveelheid zwavelzuur toegevoegd.
E°(MnO4-/Mn2+) versus E°(MnO2/Mn2+)
Ook in zuur milieu kan er mangaandioxide ontstaan wanneer de titratie te snel wordt uitgevoerd. Er ontstaat dan een bruine troebeling in het reactiemengsel door de vorming van het bruine mangaandioxide. Indien de titratie dan even wordt gestaakt, zal de bruine kleur echter terug verdwijnen en kan de titratie zonder problemen worden verdergezet.De verklaring hiervoor kan worden gegeven op basis van de normpotentialen van de twee betrokken koppels:
- E°(MnO4-/Mn2+) = 1.507V
- E°(MnO4-/MnO2)= 1.679V
MnO4- wordt dus gemakkelijker omgezet naar MnO2 dan naar Mn2+. Zelfs in zuur mileu zal dit dus gebeuren indien er te snel wordt getitreerd. MnO4- zet immers eerst om naar MnO2 en in zuur milieu zet MnO2 verder om naar Mn2+. Bij het snel toevoegen van permanganaat wordt deze tussenstap waarneembaar en soms ook niet meer teniet te doen.
KMnO4 is geen oertiterstof
Een oertiterstof is een stof waarvan voor een oplossing van deze stof de theoretische concentratie steeds gelijk is aan de werkelijke concentratie. Je kan bij een oertiterstof de concentratie perfect berekenen op basis van de afgewogen massa van deze stof. Bij KMnO4 is dit niet het geval. Omdat het zo’n sterke oxidator is, zal het immers bij contact met het minste deeltje reductor wegreageren. Indien je dus een bepaalde hoeveelheid kaliumpermanganaat afweegt en oplost in een bepaald volume water, zou je op basis van de afgewogen massa een hogere concentratie berekenen dan de werkelijke concentratie van de oplossing is. Kaliumpermangaat reageert namelijk gemakkelijk met de minste onzuiverheid, op het weegschaaltje, in de maatkolf, in het water … Een oplossing van kaliumpermanganaat dient dus steeds voor gebruik te worden gestandaardiseerd.Het sterk oxiderend vermogen van kaliumpermanganaat heeft nog andere gevolgen voor zijn gebruik in het laboratorium. Het materiaal dat voor deze oplossingen wordt gebruikt, moet vervaardigd zijn uit glas en mag niet bestaan uit kunststof of rubber. Omdat zonlicht bovendien de reductie van kaliumpermanganaat katalyseert, moeten permanganaat-oplossingen ook in het donker, bij voorkeur in donkere flessen, worden bewaard. Oplossingen met een lage concentratie kunnen niet worden bewaard. Oplossingen met een hogere concentratie kunnen eventueel wel bewaard worden maar na verloop van tijd zal er zich in deze oplossingen een bruine film (MnO2) afzetten. Dit neerslag kan door filtratie worden verwijderd en na standaardisatie van de oplossing, kan deze oplossing dus wel nog worden gebruikt. Bij oplossingen met een lage concentratie zal er zich na verloop van tijd geen kaliumpermanganaat meer in de oplossing bevinden.
Standaardisatie van een KMnO4-oplossing
Hiervoor wordt meestal gebruikt gemaakt van oxaalzuur (C2O4H2). Oxaalzuur is wel een oertiterstof. De reactie die optreedt tussen het permanganaat-ion en oxaalzuur gaat als volgt.2MnO4- + 5C2O4H2 + 6H+ → 2Mn2+ + 10CO2 + 8H2O
Een gekende massa oxaalzuur wordt hiervoor in een erlenmeyer gebracht en opgelost in een hoeveelheid water. Het aantal mol oxaalzuur kan worden berekend op basis van de molaire massa van oxaalzuur (M = 90.00 g/mol).
n = moxaalzuur / Moxaalzuur
Om de oplossing voldoende zuur te maken, wordt er wat geconcentreerd zwavelzuur toegevoegd. De oplossing dient bovendien opgewarmd te worden tot een temperatuur van ongeveer 70°C omdat de reactie endotherm verloopt en dus energie vraagt. Indien bij toevoeging van kaliumpermanganaat al het oxaalzuur is weggereageerd, zal de oplossing paars kleuren door de overmaat aan kaliumpermanganaat. Vervolgens kan de exacte concentratie van de kaliumpermanganaatoplossing worden berekend op basis van de reactievergelijking.
nMnO4- = noxaalzuur / 2 × 5
Dit aantal mol kan dan worden gedeeld door het titratievolume, het volume MnO4--oplossing dat werd toegevoegd tot kleuring. Zo wordt de exacte concentratie van de permanganaat-oplossing verkregen.
cMnO4- = nMnO4- / Vtitratie
Uitgewerkt voorbeeld van een permanganometrische bepaling
Bepaling van het ijzersulfaat-gehalte (FeSO4) in commerciële antimosReactievergelijking: 8H+ + 5Fe2+ + MnO4- → 5Fe3+ + Mn2+ + 4H2O
Materiaal:
anti-mos, KMnO4-oplossing (0.002 mol/L), H2SO4-oplossing (1mol/L).
Werkwijze:
- Weeg ongeveer 2,8 g antimos af en noteer de exacte massa (mantimos).
- Breng deze hoeveelheid antimos in een maatkolf van 250 mL en leng de oplossing aan met de H2SO4-oplossing.
- Pipetteer 25 mL van deze oplossing in een erlenmeyer.
- Titreer met de KMnO4-oplossing.
Verwerking:
- Bereken het aantal mol KMnO4 toegevoegd.nKMnO4 = cKMnO4 × Vtitratie
- Bereken op basis van de reactievergelijking het aantal mol FeSO4 in 25 mL antimos-oplossing.nFeSO4 = nKMnO4 × 5
- Bereken de massa FeSO4 in 25 ml antimos-oplossing.mFeSO4 = nFeSO4 × MFeSO4 (met MFeSO4 = de molaire massa van FeSO4 = 151.87 g/mol)
- Bereken de massa FeSO4 in 250 mL (dit is op mantimos).m = mFeSO4 × 10
- Bereken het massaprocent FeSO4 in antimos.m% = m / mantimos × 100
© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Standaardisaties bij zuur-basetitratiesJe kan de concentratie van een zure of een basische oplossing bepalen aan de hand van een zuur-basetitratie. Om de conce…
Standaardisaties bij zuur-basetitratiesJe kan de concentratie van een zure of een basische oplossing bepalen aan de hand van een zuur-basetitratie. Om de conce…
 Natrium en dichloor uit keukenzout, theoretisch bekekenWanneer je ooit de reactie tussen natriummetaal en water hebt gezien, weet je dat die vrij explosief is. De elektrolytis…
Natrium en dichloor uit keukenzout, theoretisch bekekenWanneer je ooit de reactie tussen natriummetaal en water hebt gezien, weet je dat die vrij explosief is. De elektrolytis…
 Coördinatiemechanismen van MintzbergCoördinatie is de wijze waarop de taakuitvoeringen op elkaar worden afgestemd. Organisatiekundige Mintzberg onderscheidt…
Coördinatiemechanismen van MintzbergCoördinatie is de wijze waarop de taakuitvoeringen op elkaar worden afgestemd. Organisatiekundige Mintzberg onderscheidt…
 De vergelijking van NernstDe normpotentiaal van een redoxkoppel geeft aan hoe sterk het oxiderend vermogen en het reducerend vermogen van respecti…
De vergelijking van NernstDe normpotentiaal van een redoxkoppel geeft aan hoe sterk het oxiderend vermogen en het reducerend vermogen van respecti…
 De belangrijkste concentratie-eenheden op een rijtjeIn wetenschappelijk onderzoek wordt er voor oplossingen meestal de concentratie-eenheid mol/L gebruikt. In het dagelijks…
De belangrijkste concentratie-eenheden op een rijtjeIn wetenschappelijk onderzoek wordt er voor oplossingen meestal de concentratie-eenheid mol/L gebruikt. In het dagelijks…
 De sterkte van oxidatoren en reductorenRedoxreacties zijn reacties waarbij er elektronen worden uitgewisseld tussen een oxidator en een reductor. Niet alle oxi…
De sterkte van oxidatoren en reductorenRedoxreacties zijn reacties waarbij er elektronen worden uitgewisseld tussen een oxidator en een reductor. Niet alle oxi…
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: OpenClipart-Vectors, Pixabay
- Analytical chemistry, Skoog, West en Holler
- Binas, Wolters, Noordhoff
Guust2016 (74 artikelen)
Laatste update: 17-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Laatste update: 17-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.