De sterkte van oxidatoren en reductoren
 Redoxreacties zijn reacties waarbij er elektronen worden uitgewisseld tussen een oxidator en een reductor. Niet alle oxidatoren vertonen dezelfde neiging om elektronen op te nemen en niet alle reductoren zijn even geneigd om elektronen af te geven. De sterkte van een oxidator en een reductor kan worden afgeleid uit de normpotentiaal van het redoxkoppel waartoe de oxidator of reductor behoort. Een sterke oxidator wordt gekarakteriseerd door een hoge normpotentiaal en een sterke reductor heeft een lage normpotentiaal.
Redoxreacties zijn reacties waarbij er elektronen worden uitgewisseld tussen een oxidator en een reductor. Niet alle oxidatoren vertonen dezelfde neiging om elektronen op te nemen en niet alle reductoren zijn even geneigd om elektronen af te geven. De sterkte van een oxidator en een reductor kan worden afgeleid uit de normpotentiaal van het redoxkoppel waartoe de oxidator of reductor behoort. Een sterke oxidator wordt gekarakteriseerd door een hoge normpotentiaal en een sterke reductor heeft een lage normpotentiaal.
- Oxidatoren en reductoren
- Voorbeeld van een redoxreactie
- Redoxkoppels en halfreacties
- Eenvoudige regels voor het bepalen van oxidatiegetallen (OG)
- Voorbeelden van halfreacties
- Normpotentialen (E°)
- Tabel met normpotentialen en halfreacties
- Sterkte van oxidatoren en reductoren en hun onderlinge reacties
- Voorbeelden van combinaties van redoxkoppels
Oxidatoren en reductoren
Een oxiderende stof of oxidator, ook wel oxidans genoemd, is een stof die elektronen opneemt. Een reducerende stof of een reductor, ook wel reductans genoemd, is een stof welke elektronen afgeeft. Een reductor heeft een oxidator nodig om zijn elektronen aan af te geven en omgekeerd heeft een oxidator een reductor nodig om elektronen van te krijgen. Indien een reactie opgaat tussen een oxidator en een reductor, wordt dit een redoxreactie genoemd. Een oxidator wordt bij het opnemen van elektronen zelf gereduceerd. Het oxidatiegetal van een atoom in de oxidator zal dalen. Een reductor wordt bij het afgeven van elektronen zelf geoxideerd. Het oxidatiegetal van een atoom in de reductor zal stijgen.Voorbeeld van een redoxreactie
Wanneer een tinnen plaatje (Sn) in een oplossing van loodionen (Pb2+) wordt gebracht, zal er zich wat metallisch lood (Pb) afzetten op het tinnen plaatje. Het tinnen plaatje zal bovendien in massa afnemen.Pb2+ + Sn ↔ Pb + Sn2+
Elk Sn-atoom zal in deze reactie 2 elektronen afgeven aan een Pb2+-ion. Sn reageert hier dus als een reductor en zal worden geoxideerd tot zijn geconjugeerde oxidator Sn2+. Pb2+ zal hier dus optreden als de oxidator en zal worden omgezet in zijn geconjugeerde reductor Pb.
Redoxkoppels en halfreacties
Elke oxidator die elektronen opneemt, wordt dus omgezet in zijn geconjugeerde reductor en elke reductor die elektronen afgeeft, wordt omgezet in zijn geconjugeerde oxidator. Een oxidator en zijn geconjugeerde reductor en een reductor met zijn geconjugeerde oxidator vormen redoxkoppels.Voor elk redoxkoppel kan een halfreactie worden geschreven. Een halfreactie geeft aan hoeveel elektronen een oxidator opneemt om te worden omgezet in zijn geconjugeerde reductor. Hoeveel elektronen er in een halfreactie worden uitgewisseld, hangt af van de verandering in oxidatiegetal. Het aantal elektronen dat wordt opgenomen in een halfreactie is gelijk aan de daling van het oxidatiegetal. Met een aantal eenvoudige regels kunnen de oxidatiegetallen van de atomen in een molecule worden afgeleid.
Eenvoudige regels voor het bepalen van oxidatiegetallen (OG)
- Het atoom met de grootste elektronegatieve waarde heeft een oxidatiegetal = -(8-aantal valentie elektronen) Zeer dikwijls is dit zuurstof: OG = -II (behalve in peroxiden: -I). In water (H2O) heeft zuurstof dus een oxidatiegetal van -II en in waterstofperoxide (H2O2) is het oxidatiegetal van zuurstof -I.
- Het oxidatiegetal van H = +I (behalve in hydriden: OG = -I). In water heeft waterstof dus een oxidatiegetal van +I en in lithiumhydride (LiH) is het oxidatiegetal van waterstof -I.
- Het oxidatiegetal van een ion ontstaan uit een atoom uit de groepen Ia, IIa of IIIa van het periodiek systeem is in alle samengestelde stoffen en ionen = + (nr. van de groep). Voorbeelden: Na+, Mg2+ en Al3+. Het oxidatiegetal is bij mono-atomische ionen bovendien gelijk aan de lading van het ion.
- In een neutraal deeltje is de som van de oxidatiegetallen gelijk aan 0
- In een ion is de som van de oxidatiegetallen gelijk aan de lading van het ion
Voorbeelden van halfreacties
Voorbeeld 1: Redoxkoppel Zn2+/ZnAls zinkionen (Zn2+) gereduceerd worden, wordt er metallisch zink (Zn) gevormd. Een Zn2+-ion moet twee elektronen opnemen om een Zn atoom te vormen. Voor dit koppel moet dus volgende halfreactie worden geschreven.
Zn2+ + 2e- = Zn
Voorbeeld 2: Redoxkoppel MnO4-/Mn2+
Als een permanganaation (MnO4-) in zure omstandigheden wordt gereduceerd, wordt er een Mn2+-ion gevormd. Een MnO4--ion moet hiervoor 5 elektronen opnemen.
Mn(VII)O4- + 5 e- = Mn2+
Deze halfreactie is echter nog niet in orde. Aan de kant van de oxidator MnO4- staan er 6 negatieve ladingen, 5 vanwege de éénwaardig negatief geladen elektronen en 1 vanwege het permanganaation zelf. Aan de kant van de reductor Mn2+ staan er echter 2 positieve ladingen, beiden vanwege het tweewaardig positief geladen mangaanion. Dit is onmogelijk, de lading voor en na moet gelijk zijn. Dit kan worden aangepast door positieve ladingen onder de vorm van zure protonen (H+) toe te voegen of door negatieve ladingen onder de vorm van basische hydroxide-ionen (OH-)-toe te voegen.
Voor dit voorbeeld zijn dus theoretisch volgende twee aanpassingen mogelijk.
- MnO4- + 5e- + 8H+ = Mn2+
- MnO4- + 5e- = Mn2+ + 8OH-
Experimenteel kan worden vastgesteld dat deze omzetting alleen in zuur milieu optreedt. De eerste aanpassing is dus correct.
Deze halfreactie is echter nog steeds niet in orde. Het aantal atomen voor en na moet gelijk zijn. Atomen kunnen immers niet uit het niets ontstaan of in het niets verdwijnen. In dit voorbeeld staan aan de kant van de oxidator 4 zuurstofatomen, 1 mangaanatoom en 8 waterstofatomen terwijl er aan de kant van de reductor alleen een mangaanatoom voorkomt. Aan de kant van de reductor zijn er dus 4 zuurstofatomen en 8 waterstofatomen te kort. Dit kan worden opgelost door aan de kant van de reductor 4 watermoleculen (H2O) toe te voegen. Zo wordt dan de correcte halfreactie voor het MnO4-/Mn2+-koppel verkregen.
MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
Normpotentialen (E°)
Om het oxiderend vermogen van een oxidator en hieraan rechtstreeks gelinkt het reducerend vermogen van de geconjugeerde reductor te kennen, werden redoxkoppels vergeleken met het redoxkoppel H+/H2. Het koppel H+/H2 werd dus gekozen als referentie-koppel. De deelreactie horend bij dit koppel is als volgt.2H+ + 2e- = H2
Elk redoxkoppel werd onder de vorm van een galvanische cel aan dit referentiekoppel gekoppeld. Door de elektrische verbinding zullen elektronen spontaan van het ene koppel naar het andere vloeien. In welke richting de elektronen stromen, hangt af van de sterkte van de betrokken oxidatoren en reductoren.
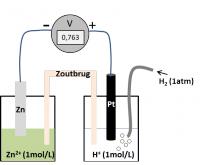
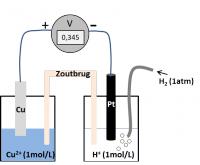
Bij deze metingen werd telkens de elektrische spanning (U) gemeten die over de galvanische cel heerste. De spanning is het verschil in potentiaal (E) tussen beide koppels. Een potentiaal op zich kan niet worden gemeten, een potentiaalverschil (spanning) wel.
U = Eoxiderend systeem - Ereducerend systeem
Men besloot om bij normomstandigheden (T = 25°C, p = 1 atm en c = 1mol/L) de normpotentiaal (E°) van het referentiekoppel gelijk te stellen aan 0V.
E°(H+/H2) = 0V
Op basis van de gemeten spanning en de afgesproken normpotentiaal van het referentie-systeem kon dus voor elk koppel de normpotentiaal worden afgeleid. Daar de spanning een positieve waarde heeft, hebben koppels waarvan de oxidator sterker is dan H+, de oxiderende systemen dus, een positieve normpotentiaal en koppels waarvan de reductor sterker is dan H2, de reducerende systemen dus, een negatieve normpotentiaal.
Tabel met normpotentialen en halfreacties
| Redoxkoppel | ||||
|---|---|---|---|---|
| Reductor | Oxidator | Halfreactie | Normpotentiaal E° (V) | |
| Li | Li+ | Li+ + e- = Li | -3.040 | |
| K | K+ | K+ + e- = K | -2.931 | |
| Ba | Ba2+ | Ba2+ + 2e- = Ba | -2.912 | |
| Sr | Sr2+ | Sr2+ + 2e- = Sr | -2.890 | |
| Ca | Ca2+ | Ca2+ + 2e- = Ca | -2.868 | |
| Na | Na+ | Na+ + e- = Na | -2.710 | |
| Mg | Mg2+ | Mg2+ + 2e- = Mg | -2.372 | |
| Be | Be2+ | Be2+ + 2e- = Be | -1.847 | |
| Al | Al3+ | Al3+ + 3e- = Al | -1.662 | |
| Mn | Mn2+ | Mn2+ + 2e- = Mn | -1.185 | |
| V | V2+ | V2+ + 2e- = V | -1.175 | |
| Cr | Cr2+ | Cr2+ + 2e- = Cr | -0.913 | |
| H2 | H2O | 2H2O + 2e- = H2 + 2OH- | -0.913 | |
| Zn | Zn2+ | Zn2+ + 2e- = Zn | -0.763 | |
| S2- | S | S + 2e- = S2- | -0.476 | |
| Fe | Fe2+ | Fe2+ + 2e- = Fe | -0.447 | |
| Cr2+ | Cr3+ | Cr3+ + e- = Cr2+ | -0.407 | |
| Cd | Cd2+ | Cd2+ + 2e- = Cd | -0.403 | |
| Cl- | ClO4- | ClO4- + 8e- + 8H+= Cl- + 4H2O | -0.359 | |
| Co | Co2+ | Co2+ + 2e- = Co | -0.280 | |
| Ni | Ni2+ | Ni2+ + 2e- = Ni | -0.257 | |
| V2+ | V3+ | V3+ + e- = V2+ | -0.255 | |
| Sn | Sn2+ | Sn2+ + 2e- = Sn | -0.137 | |
| Pb | Ni2+ | Pb2+ + 2e- = Pb | -0.126 | |
| H2 | H+ | 2H+ + e- = H2 | 0.000 | |
| S2O32- | S4O62- | 2S2O32- + 2e- = S4O62- | 0.080 | |
| IO- | IO3- | IO3- + 4e- + 2H2O= IO- + 4OH- | 0.150 | |
| Sn2+ | Sn4+ | Sn4+ + 2e- = Sn2+ | 0.151 | |
| Cu+ | Cu2+ | Cu2+ + e- = Cu+ | 0.153 | |
| U4+ | UO22+ | UO22++ 2e- + 4H+= U4+ +2H2O | 0.327 | |
| Cu | Cu2+ | Cu2+ + 2e- = Cu | 0.345 | |
| Fe(CN)64- | Fe(CN)63- | Fe(CN)63- + e- = Fe(CN)64- | 0.358 | |
| Cu | Cu+ | Cu+ + e- = Cu | 0.521 | |
| I- | I2 | I2 + 2e- = 2I- | 0.535 | |
| H2O2 | O2 | O2 + 2e- = H2O2 | 0.695 | |
| Fe2+ | Fe3+ | Fe3+ + e- = Fe+ | 0.771 | |
| Ag | Ag+ | Ag+ + e- = Ag+ | 0.800 | |
| NO2- | NO3- | NO3- + 2H+ + 2e- = NO2- + H2O | 0.934 | |
| Br- | Br2 | Br2 + 2e- = 2Br- | 1.066 | |
| I2 | IO3- | 2IO3- + 10e- + 12H+= I2 + 6H2O | 1.195 | |
| Mn2+ | MnO2 | MnO2 + 2e- + 4H+= Mn2+ + 2H2O | 1.224 | |
| H2O | O2 | O2 + 4e- + 4H+= 2H2O | 1.229 | |
| Cr3+ | Cr2O72- | Cr2O72- + 6e- + 14H+= 2Cr3+ + 7H2O | 1.232 | |
| Cl- | Cl2 | Cl2 + 2e- = 2Cl- | 1.358 | |
| Cl- | ClO3- | ClO3- + 6e- + 6H+= Cl- + 3H2O | 1.451 | |
| Pb2+ | PbO2 | PbO2 + 2e- + 4H+= Pb2+ + 2H2O | 1.455 | |
| Au | Au3+ | Au3+ + 3e- = Au | 1.500 | |
| Mn2+ | MnO4- | MnO4- + 5e- + 8H+= Mn2+ + 4H2O | 1.507 | |
| Mn2+ | Mn3+ | Mn3+ + e- = Mn+ | 1.541 | |
| Ce3+ | Ce4+ | Ce4+ + e- = Ce3+ | 1.610 | |
| Cl2 | ClO- | 2ClO- + 6e- + 2H+= Cl2 + 2H2O | 1.611 | |
| MnO2 | MnO4- | MnO4- + 3e- + 4H+= MnO2 + 2H2O | 1.679 | |
| H2O | H2O2 | H2O2 + 2e- + 2H+= 2H2O | 1.776 | |
| Co2+ | Co3+ | C03+ + e- = C02+ | 1.830 | |
| Ag+ | Ag2+ | Ag2+ + e- = Ag+ | 1.980 | |
| SO42- | S2O82- | S2O82- + 2e- = 2SO42- | 1.776 | |
| F- | F2 | F2 + 2e- = 2F- | 3.053 | |
Sterkte van oxidatoren en reductoren en hun onderlinge reacties
Hoe positiever de normpotentiaal van een redoxkoppel is, hoe heviger de oxidator van dit koppel zal reageren met H2. Hoe negatiever de normpotentiaal van een redoxkoppel is, hoe heviger de reductor van het koppel zal reageren met H+.Een redoxkoppel met een hogere normpotentiaal in vergelijking met een ander redoxkoppel bestaat uit een sterkere oxidator en een zwakkere reductor in vergelijking met het andere koppel. Indien het verschil tussen de normpotentialen groter is dan 0.25V, zal er een aflopende reactie optreden. Indien het verschil kleiner of gelijk aan 0.25V is, dan zal er zich een evenwicht instellen.
Voorbeelden van combinaties van redoxkoppels
Voorbeeld 1: Zn2+/Zn en Cu2+/CuHalfreacties:
- Zn2+ + 2e- = Zn
- Cu2+ + 2e- = Cu
Normpotentialen:
- E°(Cu2+/Cu) = 0.345V
- E°(Zn2+/Zn = -0.447V
Op basis van deze normpotentialen kan je besluiten dat het koperkoppel de oxidator levert en het zinkkoppel de reductor.
- Cu2+ is een sterkere oxidator dan Zn2+.
- Zn is een sterkere reductor dan Cu.
U = E°(Cu2+/Cu) -E°(Zn2+/Zn) = 0.345V-(-0.447V) = 0.792V < 0.25V
De reactie die optreedt is dus een aflopende reactie: Cu2+ + Zn → Cu + Zn2+
Indien een koperen plaatje in een Zn2+-oplossing wordt gebracht, zal er dus geen reactie optreden.
Voorbeeld 2: O2/H2O2 en I2/I-
Halfreacties:
- O2 + 2e- +2H+ = H2O2
- I2 + 2e- = 2I-
Normpotentialen:
- E°(O2/H2O2) = 0.695V
- E°(I2/2I-) = 0.535V
Op basis van deze normpotentialen kan je besluiten dat O2/H2O2 de oxidator levert en I2/I- de reductor.
- O2 is een sterkere oxidator dan I2.
- I- is een sterkere reductor dan H2O2.
U = E°(O2/H2O2) -E°(I2/2I-) = 0.695V - 0.535V = 0.160V ≤ 0.25V
De reactie die optreedt is dus een evenwichtsreactie: O2 + 2I- ↔ H2O2 + I2
Indien een I2-oplossing wordt gemengd met H2O2, dan zal er dus toch O2 en I- worden gevormd.
Voorbeeld 3: Al3+/Al en Pb2+/Pb
Halfreacties:
- Al3+ + 3e- = Al
- Pb2+ + 2e- = Pb
Normpotentialen:
- E°(Al3+/Al) = -1.662V
- E°(Pb2+/Pb)= -0.126V
Op basis van deze normpotentialen kan je besluiten dat Pb2+/Pb de oxidator levert en Al3+/Al de reductor.
- Pb2+ is een sterkere oxidator dan Al3+.
- Al is een sterkere reductor dan Pb.
U = E°(Pb2+/Pb) -E°(Al3+/Al) = -0.126V - (-1.662V) = 1.536V
De reactie die optreedt is dus een aflopende reactie. Om de globale reactie te schrijven dient hier de elektronenbalans wel in orde te worden gebracht. In de halfreactie van het Al3+/Al koppel worden er immers 3 elektronen uitgewisseld en in het Pb2+/Pb koppel slechts 2. Dit wordt opgelost op volgende manier.
- 2 × (Al3+ + 3e- = Al) → 2Al3+ + 6e- = 2Al
- 3 × (Pb2+ + 2e- = Pb) → 3Pb2+ + 6e- = 3Pb
De globale reactie wordt dus als volgt: 3Pb2+ + 2Al → 3Pb + 2Al3+
Indien een loden (Pb) plaatje in een Al3+-oplossing wordt gebracht, zal er dus geen reactie optreden.
© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Bleekwater en zure ontkalker, een gevaarlijke chloorcocktailBleekwater (of javel) bevat hypochlorietionen (ClO-) die als sterke oxidator fungeren t.o.v. kleurstoffen (bleekwater) e…
Bleekwater en zure ontkalker, een gevaarlijke chloorcocktailBleekwater (of javel) bevat hypochlorietionen (ClO-) die als sterke oxidator fungeren t.o.v. kleurstoffen (bleekwater) e…
 De werking van een lampje in een reddingsvestReddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden…
De werking van een lampje in een reddingsvestReddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden…
 Bepaling van normpotentialenElke redoxkoppel wordt gekenmerkt door een normpotentiaal, ook standaard redoxpotentiaal genoemd. De normpotentiaal is e…
Bepaling van normpotentialenElke redoxkoppel wordt gekenmerkt door een normpotentiaal, ook standaard redoxpotentiaal genoemd. De normpotentiaal is e…
 Natrium en dichloor uit keukenzout, theoretisch bekekenWanneer je ooit de reactie tussen natriummetaal en water hebt gezien, weet je dat die vrij explosief is. De elektrolytis…
Natrium en dichloor uit keukenzout, theoretisch bekekenWanneer je ooit de reactie tussen natriummetaal en water hebt gezien, weet je dat die vrij explosief is. De elektrolytis…
 Kwantumgetallen: van schil tot orbitaalEen atoom bestaat uit neutronen, protonen en elektronen. De neutronen en de protonen van een atoom vormen de kern van ee…
Kwantumgetallen: van schil tot orbitaalEen atoom bestaat uit neutronen, protonen en elektronen. De neutronen en de protonen van een atoom vormen de kern van ee…
 De werking van een zuur-base-indicatorZuur-base-indicatoren zijn organische zuren of basen waarvan de zure en de basische vorm een andere kleur heeft. De zuur…
De werking van een zuur-base-indicatorZuur-base-indicatoren zijn organische zuren of basen waarvan de zure en de basische vorm een andere kleur heeft. De zuur…
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: MasterTux, Pixabay
- Analytical chemistry, Skoog, West en Holler
- Binas, Wolters, Noordhoff
Guust2016 (74 artikelen)
Gepubliceerd: 03-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Gepubliceerd: 03-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.