Standaardisaties bij zuur-basetitraties
 Je kan de concentratie van een zure of een basische oplossing bepalen aan de hand van een zuur-basetitratie. Om de concentratie van zure oplossingen te bepalen, kan je deze titreren met een natriumhydroxide-oplossing met gekende concentratie. Om de concentratie van basische oplossingen te bepalen, kan je een zoutzuur- of zwavelzuuroplossing gebruiken als titrant. Deze natriumhydroxide-, zoutzuur- en zwavelzuur-oplossingen dienen steeds gestandaardiseerd te worden. Alleen zo ken je de exacte concentratie van deze oplossingen.
Je kan de concentratie van een zure of een basische oplossing bepalen aan de hand van een zuur-basetitratie. Om de concentratie van zure oplossingen te bepalen, kan je deze titreren met een natriumhydroxide-oplossing met gekende concentratie. Om de concentratie van basische oplossingen te bepalen, kan je een zoutzuur- of zwavelzuuroplossing gebruiken als titrant. Deze natriumhydroxide-, zoutzuur- en zwavelzuur-oplossingen dienen steeds gestandaardiseerd te worden. Alleen zo ken je de exacte concentratie van deze oplossingen.
- Zuur-basereacties
- Zuur-basetitraties
- Standaardisaties
- Standaardisatie van een natriumhydroxide(NaOH)-oplossing
- Standaardisatie van een zoutzuur(HCl)- en een zwavelzuur(H2SO4)-oplossing
- Uitgewerkte voorbeelden van volledige titratiebepalingen
Zuur-basereacties
Bij zuur-basereacties worden protonen uitgewisseld tussen een zuur en een base. Het zuur geeft 1 of meerdere protonen (H+) af aan de base. In een zuur-basereactie is het aantal protonen dat wordt afgegeven door het zuur gelijk aan het aantal protonen dat door de base wordt opgenomen.Voorbeelden
- De reactie tussen zoutzuur en natriumhydroxide: HCl + NaOH → NaCl + H2O. Een zoutzuurmolecule kan 1 proton afgeven en een natriumhydroxidemolecule kan 1 proton opnemen. In deze reactie reageert dus 1 HCl-molecule met 1 NaOH-molecule.
- De reactie tussen fosforzuur en natriumhydroxide: H3PO4 + 3NaOH → Na3PO4 + 3H2O. Een fosforzuurmolecule kan 3 protonen afgeven en een natriumhydroxidemolecule kan slechts 1 proton opnemen. Een H3PO4-molecule reageert dus met 3 NaOH-moleculen.
- De reactie tussen zwavelzuur en ammoniak: H2SO4 + 2NH3 → (NH4)2SO4. Een zwavelzuurmolecule kan twee protonen afgeven en een ammoniakmolecule kan 1 proton opnemen. Een H2SO4-molecule reageert dus met 2 NH3-moleculen.
Afhankelijk van de sterkte van het zuur en de base kan een zuur-basereactie aflopend of in evenwicht verlopen. Opdat een zuurbase-reactie zou kunnen worden toegepast in een zuurbase-titratie, dient het een aflopende reactie te zijn.
Zuur-basetitraties

Standaardisaties
Standaardisatie van een natriumhydroxide(NaOH)-oplossing
Waarom moet een NaOH-oplossing worden gestandaardiseerd?NaOH is een hygroscopische stof wat wil zeggen dat NaOH water uit de lucht opneemt. Indien je een korreltje NaOH op een schaaltje legt, zal je bijna onmiddellijk merken dat het korreltje begint te vervloeien. Indien je dus een NaOH-oplossing bereid uitgaande van vaste NaOH zal je steeds een kleine hoeveelheid water mee afwegen. De concentratie die je berekent op basis van de afgewogen hoeveelheid NaOH, de theoretische concentratie, zal dus hoger zijn dan de werkelijke concentratie. Om de werkelijke concentratie te kennen, dien je een NaOH-oplossing dus te standaardiseren.
Standaardisatie van een NaOH-oplossing op oxaalzuur
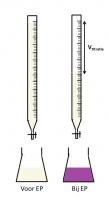
Titratiereactie:
HOOCCOOH + 2NaOH → NaOOCCOONa + 2H2O
Oxaalzuur is een oertiterstof, wat wil zeggen dat je de exacte hoeveelheid oxaalzuur kan bepalen op basis van de afweging. Voor de standaardisatie wordt een bepaalde hoeveelheid oxaalzuur in een erlenmeyer gebracht. Hierbij wordt een hoeveelheid demiwater gevoegd zodat het oxaalzuur in oplossing gaat. Voor een erlenmeyer van 250 mL wordt meestal een 25 mL demiwater gebruikt. De te standaardiseren NaOH-oplossing wordt in de buret gebracht.
Fenolftaleïne (FFT) is een geschikte zuur-base indicator voor deze standaardisatie en deze wordt toegevoegd aan de oxaalzuuroplossing in de erlenmeyer. Fenolftaleïne is kleurloos bij een pH < 8 en bij een hogere pH kleurt fenolftaleïne paars. Bij de standaardisatie van een NaOH-oplossing zal bij aanvang de pH in de erlenmeyer lager zijn dan 8 door de aanwezigheid van het zuur (oxaalzuur). Voor het EP is de oplossing in de erlenmeyer dus kleurloos. Bij het EP is alle oxaalzuur weggereageerd en zal de volgende toegevoegde druppel NaOH-oplossing niet meer kunnen reageren. Hierdoor zal de pH in de erlenmeyer stijgen en zal FFT paars kleuren. Op basis van het toegevoegde volume van de NaOH-oplossing kan de exacte concentratie van de NaOH-oplossing worden bepaald.
Hoeveel oxaalzuur moet je gebruiken voor de standaardisatie?
De nodige hoeveelheid oxaalzuur hangt af van de theoretische concentratie van de NaOH-oplossing. Stel dat je een NaOH-oplossing hebt bereid met een theoretische concentratie van 0.1 mol/l, dan weet je dat de concentratie niet exact 0.1 mol/L is maar wel in de buurt zal liggen. Een goed titratievolume (het volume dat wordt toegedruppeld vanuit de buret) ligt tussen de 20,0 en de 30,0 mL. Indien je een hoger titratievolume hebt, ben je titrant aan het verspillen. Indien je een lager titratievolume hebt, dan verhoogt de relatieve fout van de meting en daalt dus ook de nauwkeurigheid van de meting. Je kan dus vooraf berekenen wat de geschikte hoeveelheid oxaalzuur is voor een bepaalde standaardisatie.
Rekenvoorbeeld moxaalzuur
Stel een NaOH-oplossing met een theoretische concentratie van 0.1 mol/L. Je wenst een titratievolume van ongeveer 0.025L. Je zal tijdens de titratie dus ongeveer 0.1 mol/L × 0.025 L = 0.0025 mol NaOH verbruiken. Op basis van de reactievergelijking weet je dat 1 molecule oxaalzuur reageert met 2 moleculen NaOH of dat 1 mol oxaalzuur reageert met 2 mol NaOH. Een geschikte hoeveelheid oxaalzuur voor deze titratie is dus 0.0025 mol /2 = 0.00125 mol. Met de molaire massa, Moxaalzuur = 90.04 g/mol, dien je dus 0.00125 mol × 90.04 g/mol = 0.113 g oxaalzuur af te wegen en te titreren met de NaOH-oplossing. Let wel op, meestal wordt er in laboratoria gebruik gemaakt van het commerciële oxaalzuur-dihydraat (HOOCCOOH.2H2O) en dit heeft een molaire massa M van 126.07 g/mol. Hiervan dient dus 0.00125 mol × 126.07 g/mol = 0.158 g te worden afgewogen.
Rekenvoorbeeld van een standaardisatie
Stel dat je 0.00125 mol oxaalzuur in de erlenmeyer hebt gebracht en je krijgt een kleuromslag nadat je 30,0 mL van de NaOH-oplossing hebt toegevoegd. 0.00125 mol oxaalzuur heeft gereageerd met 0.0025 mol NaOH welke in 30,0 mL oplossing zat. De concentratie van de NaOH-oplossing is dus: 0.0025 mol / 0.0300 L = 0.083 mol/L.
Standaardisatie van een zoutzuur(HCl)- en een zwavelzuur(H2SO4)-oplossing
Net als NaOH is zwavelzuur een sterk hygroscopische stof. Zwavelzuur is in de handel te verkrijgen in de vorm van een waterige oplossing. Bij het pipetteren van een bepaalde hoeveelheid van deze oplossing, ben je ook nooit zeker van de exactheid van deze hoeveelheid. Je weet immers niet hoeveel water er uit de lucht werd opgenomen tijdens het pipetteren.HCl is in zuivere vorm een gas en is in de handel ook verkrijgbaar als een waterige oplossing. Indien je een fles met een geconcentreerde HCl-oplossing laat openstaan, zal je onmiddellijk het gevaarlijk HCL in je neus voelen prikkelen. HCl ontsnapt dus heel gemakkelijk uit een oplossing. Bij het maken van een HCl-oplossing weet je dus nooit hoeveel HCl er uit de oplossing is ontsnapt en daarom dien je een HCl-oplossing dus ook steeds te standaardiseren.
Standaardisatie van een HCl- en een H2SO4-oplossing op natriumcarbonaat
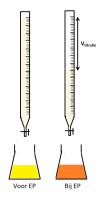
Titratiereacties:
- Na2CO3 + 2HCl → 2NaCl + H2CO3
- Na2CO3 + H2SO4 → Na2SO4 + H2CO3
In beide gevallen wordt er tijdens de titratie koolzuur (H2CO3) gevormd in de erlenmeyer. Bij het EP gaat de pH dus van licht zuur door het zwakke koolzuur naar sterk zuur door het sterke zout- of zwavelzuur. Een geschikte pH indicator hiervoor is methyloranje (MO) met een omslaggebied tussen pH = 3.1 en pH = 4.4. Bij een pH onder de 3.1 heeft MO een oranje kleur en boven de 4.4 kleurt MO geel. Bij de standaardisatie van zout- en zwavelzuur op Na2CO3 zal bij het EP de oplossing in de erlenmeyer dus omslaan van geel naar oranje.
Hoeveel natriumcarbonaat moet je gebruiken voor de standaardisatie?
Ook bij de standaardisatie op Na2CO3 kan vooraf worden berekend wat een geschikte hoeveelheid Na2CO3 is voor deze standaardisatie.
Rekenvoorbeeld mnatriumcarbonaat
Stel je hebt een H2SO4-oplossing bereid met een theoretische concentratie van 0.5 mol/L. Je wenst een titratievolume van ongeveer 0.025 L. Je zal dus theoretisch 0.5 mol/L × 0.025 L = 0.0125 mol H2SO4 verbruiken. 1 mol H2SO4 reageert met 1 mol Na2CO3. Je dient dus 0.0125 mol Na2CO3 af te wegen. Met de molaire massa M(Na2CO3) van 106 g/mol weet je dus dat je 0.0125 mol * 106 g/mol = 1.33 g in de erlenmeyer moet brengen samen met een hoeveelheid water om het natriumcarbonaat op te lossen.
Rekenvoorbeeld van een standaardisatie
Stel je hebt 0.0063 mol Na2CO3 in de erlenmeyer gedaan en en je hebt 0.027 L van een HCl-oplossing toegevoegd tot het EP werd bereikt. 1 mol Na2CO3 reageert met 2 mol HCl. 0.0063 mol Na2CO3 heeft dus gereageerd met 0.0063 mol × 2 = 0.0126 mol HCl. Deze 0.0126 mol HCl zat in 0.027 L HCl-oplossing. De exacte concentratie van de HCl-oplossing is dus 0.0126 mol / 0.027 L = 0.47 mol/L.
Uitgewerkte voorbeelden van volledige titratiebepalingen
Bepaling van de concentratie van een H3PO4-oplossingStel een onbekende H3PO4-oplossing met een concentratie tussen de 0.05 en 0.15 mol/L. Voor de bepaling van de exacte concentratie ga je hier het beste uit van een concentratie van 0.1 mol/L. Daar H3PO4 een zuur is, dien je dus een NaOH-oplossing te maken als titrant.
Titratiereactie: H3PO4 + 3NaOH → Na3PO4 + 3H2O
Er is dus 3 mol NaOH nodig om 1 mol H3PO4 te laten wegreageren. In een erlenmeyer van 250 mL zal je bijvoorbeeld 25 mL van de onbekende H3PO4-oplossing brengen. Uitgaande van de veronderstelling dat de concentratie van deze oplossing ongeveer 0.1 mol/L zal zijn, heb je dus ongeveer 0.1 mol/L × 0.025 L = 0.0025 mol H3PO4 in de erlenmeyer gebracht.
Om dit te laten wegreageren, dien je 0.0025 mol × 3 = 0.0075 mol NaOH toe te voegen. Je wenst een titratievolume van 25.0 mL. Je dient dus een NaOH-oplossing met een concentratie van 0.0075 mol / 0.025 L = 0.3 mol/L te bereiden. Voor de standaardisatie van deze NaOH-oplossing dien je dus 0.0075 mol / 2 × 90.04 g/mol = 0.34 g oxaalzuur af te wegen. Zowel voor de bepaling als voor de standaardisatie kan je FFT als zuur-base indicator gebruiken.
Bepaling van de concentratie van een NH3-oplossing
Stel een onbekende NH3-oplossing met een concentratie tussen de 0.2 en 0.3 mol/L. Voor de bepaling van de exacte concentratie ga je hier het beste uit van een concentratie van 0.25 mol/L. Daar NH3 een base is, kan je dus een HCl- of een H2SO4-oplossing maken als titrant. Stel dat je voor een HCl-oplossing kiest.
Titratiereactie: NH3 + HCl → NH4Cl
Er is dus 1 mol HCl nodig om 1 mol NH3 te laten wegreageren. In een erlenmeyer van 250 mL zal je bijvoorbeeld 25 mL van de onbekende NH3-oplossing brengen. Uitgaande van de veronderstelling dat de concentratie van deze oplossing ongeveer 0.25 mol/L zal zijn, heb je dus ongeveer 0.25 mol/L × 0.025 L = 0.0063 mol NH3 in de erlenmeyer gebracht.
Om dit te laten wegreageren, dien je ook 0.0063 mol HCl toe te voegen. Je wenst een titratievolume van 25.0 mL. Je dient dus een HCl-oplossing met een concentratie van 0.0063 mol / 0.025 L = 0.252 mol/L te bereiden. Voor de standaardisatie van deze HCl-oplossing dien je dus 0.0063 mol / 2 × 106 g/mol = 0.33 g natriumcarbonaat af te wegen. Zowel voor de bepaling als voor de standaardisatie kan je MO als zuur-base indicator gebruiken.
Wat als je geen richtwaarde hebt voor de onbekende oplossing?
In bovenstaande voorbeelden werd steeds een richtwaarde gegeven van de concentraties van de onbekende oplossingen. Dit is uiteraard niet steeds het geval. In het geval van een oplossing waarvan je geen enkel idee hebt van de concentratie start je het beste met wat testtitraties. Voor bijvoorbeeld de concentratiebepaling van een onbekende zure oplossing, maak je eerst NaOH-oplossingen met verschillende concentraties. Op basis van de testtitraties van de onbekende oplossing met deze NaOH-testoplossingen kan je dan nagaan wat een geschikte NaOH-concentratie is voor deze bepaling. Pas als je deze weet, ga je aan de slag met de standaardisatie van de geschikte NaOH-oplossing.
© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 De werking van een redoxindicatorOm het equivalentiepunt bij een redoxtitratie met kleurloze of weinig gekleurde oplossingen te kunnen zien, dient een re…
De werking van een redoxindicatorOm het equivalentiepunt bij een redoxtitratie met kleurloze of weinig gekleurde oplossingen te kunnen zien, dient een re…
 Jodo-jodimetrie, een veelzijdige techniekJodo-jodimetrie is een redoxmethode gebaseerd op titrimetrie. De methode kan worden gebruikt voor tal van toepassingen w…
Jodo-jodimetrie, een veelzijdige techniekJodo-jodimetrie is een redoxmethode gebaseerd op titrimetrie. De methode kan worden gebruikt voor tal van toepassingen w…
 Conductometrie als alternatief voor zuur-basetitratiesEen conductometrische titratie is een volumetrische concentratiebepaling waarbij de geleidbaarheid van het reactiemengse…
Conductometrie als alternatief voor zuur-basetitratiesEen conductometrische titratie is een volumetrische concentratiebepaling waarbij de geleidbaarheid van het reactiemengse…
 De werking van een zuur-base-indicatorZuur-base-indicatoren zijn organische zuren of basen waarvan de zure en de basische vorm een andere kleur heeft. De zuur…
De werking van een zuur-base-indicatorZuur-base-indicatoren zijn organische zuren of basen waarvan de zure en de basische vorm een andere kleur heeft. De zuur…
 Kwantumgetallen: van schil tot orbitaalEen atoom bestaat uit neutronen, protonen en elektronen. De neutronen en de protonen van een atoom vormen de kern van ee…
Kwantumgetallen: van schil tot orbitaalEen atoom bestaat uit neutronen, protonen en elektronen. De neutronen en de protonen van een atoom vormen de kern van ee…
 Atoomabsorptie- en atoomemissiespectrofotometrie (AAS/AES)Atoomabsorptiespectrofotometrie (AAS) en atoomemissiespectrofotometrie (AES) zijn zeer specifieke spectrofotometrische m…
Atoomabsorptie- en atoomemissiespectrofotometrie (AAS/AES)Atoomabsorptiespectrofotometrie (AAS) en atoomemissiespectrofotometrie (AES) zijn zeer specifieke spectrofotometrische m…
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: OpenClipart-Vectors, Pixabay
- Fundamentals of chemical chemistry, Skoog, West en Holler
- Fundamentele begrippen van algemene chemie, K. Bruggemans en Y. Herzog
Guust2016 (74 artikelen)
Laatste update: 21-10-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Laatste update: 21-10-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.