Bohrium: Een radioactief synthetisch element
 Bohrium is een scheikundig element met symbool Bh, atoomnummer 107, aantal neutronen 155. Het is vernoemd naar de Deense fysicus Niels Bohr. Bohrium is een radioactief synthetisch element (een element dat in een laboratorium wordt gemaakt). De meest stabiele isotoop, 270Bh, heeft een halfwaardetijd van ongeveer 61 seconden. Experimenten bevestigen dat Bohrium zich gedraagt als de elementen uit groep 7. Het is een zware metaal met een dichtheid van 37,1 te g/cm3, dat is op meitnerium (37,4 g/cm3) en Hassium (41 g/cm3) na de hoogste dichtheid van de elementen. Vanwege de korte halveringstijden van de Bohriumisotopen is onderzoek naar de chemische en fysische eigenschappen moeilijk.
Bohrium is een scheikundig element met symbool Bh, atoomnummer 107, aantal neutronen 155. Het is vernoemd naar de Deense fysicus Niels Bohr. Bohrium is een radioactief synthetisch element (een element dat in een laboratorium wordt gemaakt). De meest stabiele isotoop, 270Bh, heeft een halfwaardetijd van ongeveer 61 seconden. Experimenten bevestigen dat Bohrium zich gedraagt als de elementen uit groep 7. Het is een zware metaal met een dichtheid van 37,1 te g/cm3, dat is op meitnerium (37,4 g/cm3) en Hassium (41 g/cm3) na de hoogste dichtheid van de elementen. Vanwege de korte halveringstijden van de Bohriumisotopen is onderzoek naar de chemische en fysische eigenschappen moeilijk.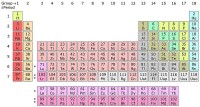 Periodiek systeem. Bohrium atoomnummer 107. / Bron: Sandbh, Wikimedia Commons (CC BY-SA-4.0)
Periodiek systeem. Bohrium atoomnummer 107. / Bron: Sandbh, Wikimedia Commons (CC BY-SA-4.0)Ontdekking van Bohrium
Bohrium wordt voor het eerst genoemd door Russische onderzoekers in 1976. Bismut-209 en Lood-208 werden beschoten met kernen van Chromium-54 en Mangaan-58. De resultaten waren voor de wetenschappelijke wereld niet overtuigend. Een Duits team onder leiding van Peter Armbruster en Gottfried Münzenberg in het Instituut voor Heavy Ion Research in Darmstadt, bombardeerde in 1981 Bismut-209 met kernen van Chroom-54-5 waarbij atomen van de Bohrium 262 isotoop ontstonden. Het resultaat was vijf atomen van de isotoop Borium-262:- 209/83Bi + 54/24Cr → 262/107Bh + n
Voorkomen op aarde
Bohrium komt niet op aarde voor het wordt gemaakt in laboratoria. Niels Bohr / Bron: Publiek domein, Wikimedia Commons (PD)
Niels Bohr / Bron: Publiek domein, Wikimedia Commons (PD)Het ontstaan van de naam Bohrium
De Duitsers stelden de naam Nielsbohrium voor met symbool Ns om de Deense fysicus Niels Bohr te eren. De Duitsers wilden zowel de Deense fysicus Niels Bohr eren en tegelijk erkennen dat het Russische Dubna-team de eerste was die over de ontdekking van Bhorium hebben gepubliceerd. Men kwam overeen dat Dubnium de naam werd voor element 107, een "dochter" van Bohrium. Het werd tenslotte dus Bohrium wat niet zelden verwarring onder niet natuurkundigen oplevert, vanwege het bestaande element "Boor" dat ook Borium (zonder h) genoemd wordt.Kenmerken van het atoom
- Naam: Bohrium (niet te verwarren met Borium)
- Symbool: Bh
- Atoomnummer: 107
- Groep: 7 Mangaan (Mn), Technetium (Tc), Rhenium (Re)
- Periode: 7
- Blok: d
- Reeks: Transitiemetaal
- Ontdekking: Geïsoleerd in 1981 door 'Gesellschaft für Schwerionenforschung', Darmstadt
 Kristalstructuur hexagonale dichtste pakking / Bron: HKoster
Kristalstructuur hexagonale dichtste pakking / Bron: HKosterChemische eigenschappen van Bohrium
- Atoommassa: 270
- Elektronenconfiguratie: 28 - 18 - 32 - 32 - 13 - 2; Subschillen: 5 - f14 - 6d5 - 7s2
- Oxidatiestaten: 7, (5), (4), (3); staten tussen haakjes zijn voorspellingen
- Atoomstraal Pm: Empirisch: 128, Covalent 141
- Ionisatiepotentiaal KJ/mol: 1e: 742.9l - 2de: 1688.5 l - 3de: 2566.5 l (voorspellingen)
Fysische eigenschappen van Bohrium
- Dichtheid 37,1 g/cm3
- Aggregatie staat: Vast bij kamertemperatuur
- Kristalstructuur: Hexagonaal dichtste pakking (hcp)
Isotopen van Bohrium
Bohrium heeft geen stabiele isotopen en komt niet in de natuur voor, daarvoor is de halfwaardetijd te kort. De radioactieve Bohrium isotopen zijn geproduceerd in het laboratorium. Het verval naar de diverse isotopen gebeurt door alfaverval, dat wil zeggen door emissie van heliumkernen.De lichtere isotopen hebben een kortere halfwaardetijd. De halfwaardetijd is minder dan 100 milliseconden voor 260Bh, 261Bh, 262Bh en 262mBh. De isotopen 264Bh, 265Bh, 266Bh en 271Bh zijn stabieler met een halfwaardetijd van ongeveer 1 seconde, 267Bh en 272Bh hebben een halfwaardetijd van ongeveer 10 seconden. De zwaarste isotopen zijn stabieler dan de lichtere, de halfwaardetijden van 270Bh en 274Bh bedragen respectievelijk 61 en 54 seconden.
De proton-rijke isotopen 260Bh, 261Bh en 262Bh zijn geproduceerd door koude fusie door het bombarderen van bismuth met Chroomatomen. De isotopen 262Bh en 264Bh bevinden zich in de vervalketen van Roentgenium en Meitnerium.
De neutronen-rijke isotopen 265Bh, 266Bh en 267Bh ontstaan door bestraling van atomen uit de actinegroep. De meest neutron-rijke 270Bh, 271Bh, 272Bh en 274Bh komen voor in de vervalketens van 282Uut, 287Uup, 288Uup en 294Uus. De Bohrium-isotoop 262Bh heeft een halfwaardetijd van tien milliseconden, en 270Bh en 2t4Bh circa een minuut.
Meest stabiele isotopen van Bohrium
| Iso | n.v.t. | Halfwaardetijd | Vervalmodus | DE(MeV) | Vervalproduct |
|---|---|---|---|---|---|
| 274Bh | Synthetisch | 54 sec | α | 8,8 | 270Db |
| 272Bh | Synth | 9,8 sec | α | 9,02 | 268Db |
| 271Bh | Synth | 1,2 sec | α | 9,35 | 267Db |
| 270Bh | Synth | 61sec | α | 8,93 | 266Db |
| 267Bh | Synth | 17 sec | α | 8,83 | 263Db |