Calcium: Het element
 Calcium is een zacht zilverwit aardalkalimetaal dat in 1808 als element werd ontdekt en door middel van elektrolyse geproduceerd door Humphry Davy. De naam is afkomstig van het Latijnse Calx, "kalksteen". Het wordt aangetast door zuurstof uit de lucht en reageert heftig met water. Calcium is letterlijk van levensbelang voor mens en dier. Calciumverbindingen kennen we verder o.a. als kalk, marmer, gips, cement en in de metallurgie voor de productie van hoogwaardige metaallegeringen. Calcium reageert met halogenen tot halogeniden en bij verhitting met stikstof tot nitride met zwavel tot sulfide.
Calcium is een zacht zilverwit aardalkalimetaal dat in 1808 als element werd ontdekt en door middel van elektrolyse geproduceerd door Humphry Davy. De naam is afkomstig van het Latijnse Calx, "kalksteen". Het wordt aangetast door zuurstof uit de lucht en reageert heftig met water. Calcium is letterlijk van levensbelang voor mens en dier. Calciumverbindingen kennen we verder o.a. als kalk, marmer, gips, cement en in de metallurgie voor de productie van hoogwaardige metaallegeringen. Calcium reageert met halogenen tot halogeniden en bij verhitting met stikstof tot nitride met zwavel tot sulfide. Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0)Plaats van calcium in het periodiek systeem
Calcium is een aardalkalimetaal en bevindt zich in kolom 2 van het periodiek systeem. Alle aardalkalimetalen hebben twee valentie-elektronen die ze relatief gemakkelijk afstaan, zo ontstaan de calciumionen Ca+2 die zich met talrijke andere elementen kunnen verbinden.| Naam | Symbool | Atoomnummer | Groep | Periode | Blok | Reeks | Kleur |
|---|---|---|---|---|---|---|---|
| Calcium | Ca | 20 | Aardalkalimetalen Beryllium Magnesium Calcium Strontium Barium Radium | periode 4 | S-blok | Aardalkalimetalen | Zilverwit |
Chemische eigenschappen van het element calcium
| Atoommassa (u) | Elektronenconfiguratie | Oxidatietoestanden | Elektronegativiteit (Pauling) | Atoomstraal (pm) | ionisatiepotentiaal (kJ/mol) |
|---|---|---|---|---|---|
| 40 | [Ar]4s2 | +2 | 1,00 | 197 | 1e 590 2e 1146 3e 4912 |
Fysische eigenschappen van het element calcium
| Dicht heid (kg/m3) | Hard heid (Mohs) | Smelt punt (K) | Kook punt (K) | Smelt warmte (kJ/mol) | Verdamp ings warmte (kJ/mol) | Kristal structuur (20oC) | Geluids snelheid (m/s) | Speci fieke warmte (J/kg.K) | Elek trische weerstand (μΩ•cm) | Warmte geleiding (W/m.K) |
|---|---|---|---|---|---|---|---|---|---|---|
| 1550 | 1,75 | 1112 | 1767 | 8,5 | 154 | KVG | 3810 | 630 | 3,91 | 200 |
De stabielste isotopen van het element calcium
In de natuur voor.Van calcium zijn meerdere stabiele isotopen bekend, 40Ca en 44Ca komt in ruime mate voor in de aardkorst.| Isotoop | RA(%) | Halveringstijd | Verval | VE(MeV) | Vervalproduct |
|---|---|---|---|---|---|
| 40Ca | 96,9 | Stabiel met 20 neutronen | [/TD][TD] | [/TD] | |
| synthetisch | 1x10↑5 jaar | beta+ | 11,1 | 41K | |
| 42Ca | 0,65 | stabiel met 22 neutronen | [/TD][TD] | [/TD] | |
| 0,14 | stabiel met 23 neutronen | [/TD][TD] | [/TD] | ||
| 2,1 | stabiel met 24 neutronen | [/TD][TD] | [/TD] | ||
| synthetisch | 162,6 dagen | beta- | 4,2 | 45Sc | |
| 46Ca | 0,004 | stabiel met 26 neutronen | [/TD][TD] | [/TD] | |
| synthetisch | 4,5 dagen | Beta- | 1,99 | 47Sc | |
| 48Ca | 0,19 | 6 x 10↑18 jaar | 2beta- | 4,3 | 48,Ti |
 Calcium / Bron: Tomihahndorf, Wikimedia Commons (CC BY-SA-3.0)
Calcium / Bron: Tomihahndorf, Wikimedia Commons (CC BY-SA-3.0)Voorkomen van calcium
De aardkorst bevat ruim 4 gew.% en is daarmee het op vijf na meest voorkomende element in de aardkorst. Door de reactieve eigenschappen komt het alleen in verbindingen voor. Bekende calciumhoudende mineralen zijn calciet (calciumcarbonaat), gips (calciumsulfaat) en fluoriet (calciumfluoride). Calcium wordt gewonnen door elektrolyse van calciumchloride en calciumfluoride.Opgelost calcium in de oceanen wordt door macro- en micro-organismen gebruikt om skeletten te vormen die tenslotte als sediment naar de bodem zinken.
Eigenschappen van calcium
Calcium is letterlijk van levensbelang voor aards leven. Het reageert met water onder vorming van calciumhydroxide. Dit is een exotherme reactie. Calcium fosfaat is zeer giftig voor waterorganismen.Calcium carbonaat (CaCO3) is een van de meest voorkomende calciumverbindingen. Het wordt verwarmd tot ongebluste kalk (CaO) en vervolgens toegevoegd aan water (H2O). Dit vormt een ander materiaal dat bekend staat als gebluste kalk (Ca(OH)2).
Kalksteen en marmer zijn twee vormen van calciumcarbonaat.
Uit calcium fosfaat (Ca3(PO4)2), vormen zich de dierlijke en menselijke beenderen en tanden.
Toepassingen van calcium
- Reductor bij extractie van metalen zoals uranium, zirkonium en thorium.
- In de vorm van calciumoxide is het de grondstof van veel bouwmaterialen zoals cement.
- Calcium wordt toegepast als legeringselement in metaallegeringen, in combinatie met aluminium, beryllium, koper, lood en magnesium.
- Calciumcarbonaat wordt gebruikt voor de productie van witte verf, schoonmaakmiddel, tandpasta en maagtabletten.
- Calciumsulfaat (CaSO4), bekend als gips om droge muren te maken.
- Calcium nitraat (Ca(NO3)2), een natuurlijke mestsoort.
- Calcium wordt gebruikt om zuurstof, zwavel en koolstof te verwijderen uit legeringen.
- Calcium wordt ook gebruikt in vacuüm extractie als een materiaal dat gassen verwijdert uit het systeem.
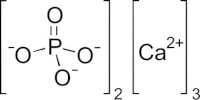 Calciumfosfaat(Ca3(PO4)2) / Bron: RicHard 59, Wikimedia Commons (CC BY-SA-3.0)
Calciumfosfaat(Ca3(PO4)2) / Bron: RicHard 59, Wikimedia Commons (CC BY-SA-3.0)- Calciumfosfaat werkt onder andere als:
- Zuurte regeling in voedingsmiddelen.
- Broodverbeteraar.
- Binden van metalen.
- Versterken van de antioxidant activiteit.
- Antiklontermiddel.
- Schuurmiddel in tandpasta.
Calciumfosfaat heeft als voedingsadditief EE-nummer E341(c). De aanvaardbare inname (ADI) van calcium is maximaal 70 mg/kg lichaamsgewicht. De stof heeft geen bekende bijwerkingen.
Calcium in de biologie
- Calcium is het meest voorkomende metaal in het menselijk lichaam.
- Calcium is het hoofdbestanddeel van beenderen en tanden.
- In het bloed is calcium gebonden aan eiwitten (40%), aan negatief geladen ionen (10%), en als actieve vrije calciumionen (Ca2+) die een belangrijke rol spelen in de biochemische en fysiologische processen in de cellen van organismen. Veel enzymen vereisen calciumionen, zoals bij het bloedstollings mechanisme.
- Het calciumgehalte in het bloed wordt geregeld door vitamine D en het hormoon PTH. Te veel PTH, PTH-achtige hormonen en vitamine D kan een verhoogd calciumniveau in het bloed veroorzaken. Een verlaagd niveau komt voor bij therapie met bepaalde medicijnen.
- Calcium is nodig bij de samentrekking van spiercellen.
- Calcium is belangrijk bij de bevruchting en de voortplanting.
Calcium in de voeding
Een gevarieerde voeding zorgt voor voldoende opname van calcium door het lichaam, zoals melk en melkproducten, groente, noten en peulvruchten.
Te hoog calciumgehalte
- Een te hoog calciumgehalte in het bloed heet hypercalciëmie. Verstoorde calciumstofwisseling kan hypercalciëmie veroorzaken. Normaal wordt de calciumspiegel op peil gehouden door hormonen en vitamine D.
- Hypercalciëmie kan ook veroorzaakt worden door botkanker of kanker met uitzaaiingen in de botten. Ook tumoren kunnen de oorzaak zijn van een te veel aan calcium in het bloed.
- Te snel werkende bijschildklieren veroorzaken onregelmatigheden door verhoogde afgifte van het parathyroïdhormoon (PTH), dat grote invloed heeft op het calcium gehalte in het bloed.
- Een hoog calciumgehalte in het bloed leidt tot vermoeidheid en als de hoeveelheid calcium blijft oplopen is er kans op misselijkheid, obstipatie, veel plassen, dorst, braken, diarree en traagheid.